ATENÇÃO !!!
Preferencialmente use o Navegador Chrome ![]() ou Mozilla Firefox
ou Mozilla Firefox ![]()
Informe n° 26/2025 – Novo módulo de Programação Ascendente de insumos de Prevenção – 30/12/2025
Como encaminhamento da reunião realizada no dia 11/11/2025, às 10h, a Programação Ascendente (PA) de Insumos de Prevenção no módulo Gerencial do SICLOM terá início em primeiro de janeiro de 2026. Dessa forma, o processo de ressuprimento de insumos de prevenção será realizado exclusivamente por meio da PA do SICLOM Gerencial. Vale destacar alguns prazos e medidas acordados acerca dessa implementação:
✔ Cobertura estimada acordada: 5 meses • O prazo de cobertura estimada poderá ser reavaliado após seis meses de implementação da PA de insumos de prevenção.
✔ Alteração da data de fechamento do Mapa e do pedido de ressuprimento: até o dia 10 de cada mês • A antecipação para até o dia 10 de cada mês (em substituição ao atual dia 15) contribuirá para que as distribuições de insumos de prevenção aprovadas pela PA possam ser efetivamente entregues dentro do mesmo mês do pedido de ressuprimento.
✔ Comunicado mensal de atendimento da PA: • Mensalmente, o Dathi encaminhará e-mail circular (destinado às coordenações e equipes de logística de prevenção cadastradas no SICLOM Gerencial) com o panorama geral de atendimento da PA: • insumos com atendimento integral, parcial ou não atendidos; • justificativas para o atendimento parcial ou não atendimento; • previsão de normalização, quando aplicável.
Seguem anexos o manual (em formato PDF) e os vídeos com orientações sobre a utilização da PA de Insumos de Prevenção no SICLOM Gerencial.
👉 Acesse o Manual
👉 Vídeo – Pedido de Ressuprimento
👉 Vídeo – Recebimento de Insumo
Permanecemos à disposição em caso de dúvidas e sugestões de melhorias pelos seguintes canais:
| Atendimento relacionado à área de prevenção do HIV/Aids | Atendimento relacionado à área de Controle de Medicamentos e Insumos | Atendimento ao Usuário(a) do SICLOM |
|
E-mail: prevencao.hiv@aids.gov.br
|
E-mail: logistica@aids.gov.br
|
E-mail: siclom@aids.gov.br
|
Informe Nº 25 – Integração sistema Laudo e SICLOM – Prescrição para TARV para HIV/Aids Adultos e adolescentes – 11/12/2025
Prezados(as),
Informamos que foi publicada a Nota Técnica nº 234/2025 – CGHA/DATHI/SVSA/MS , que apresenta a integração entre o Sistema Laudo e o SICLOM para a prescrição e dispensação da Terapia Antirretroviral (TARV) para adolescentes e adultos.
A atualização permite que as prescrições realizadas no Sistema Laudo sejam enviadas automaticamente ao SICLOM, qualificando a assistência, fortalecendo a segurança do usuário e agilizando o processo de dispensação nas UDM.
O Laudo passa a incorporar o formulário de solicitação de medicamentos do SICLOM, com validação clínica antecipada, checagem automatizada conforme o PCDT e suporte à decisão para o prescritor.
Nas UDMs, a dispensação torna-se mais rápida: as informações da prescrição chegam prontas ao SICLOM, sem necessidade de digitação manual. Em casos de indisponibilidade de internet ou computador, permanece vigente o procedimento alternativo (preenchimento manual do formulário) já orientado pelo DATHI.
A medida reforça a integração entre a assistência clínica e a gestão logística, promovendo maior segurança, eficiência e qualidade no cuidado às pessoas vivendo com HIV.
👉 Acesse a Nota Técnica nº 234/2025
👉 Vídeo – Prescrição no Sistema Laudo
👉 Vídeo – Dispensação no SICLOM
Para esclarecimentos adicionais ou maiores informações, utilize um dos canais de comunicação disponíveis:
| Atendimento relacionado aos Protocolos Clínicos e Diretrizes Terapêuticas | Atendimento relacionado à área de Controle de Medicamentos ARV | Atendimento ao Usuário do SICLOM | Atendimento ao usuário do Laudo |
|
E-mail: tratamento@aids.gov.br
|
E-mail: logistica@aids.gov.br
|
E-mail: siclom@aids.gov.br
|
E-mail: laudo@aids.gov.br
|
Informe n° 24/2025 – Atualização dos campos “situação do Migrante” no Siclom - 05/11/2025
Prezados(as) farmacêuticos/as e dispensadores/as,
Informamos que o Sistema de Controle Logístico de Medicamentos (SICLOM) passou a adotar o termo “situação do migrante” em substituição ao campo anteriormente denominado “situação do estrangeiro”. Essa atualização encontra-se disponível nos menus de cadastro de Pessoas Vivendo com HIV/aids (PVHA), cadastro de usuários de Profilaxia Pré-Exposição ao HIV (PrEP) e na opção de dispensação da Profilaxia Pós-Exposição ao HIV (PEP).
A alteração tem como objetivo alinhar o sistema às atuais diretrizes de inclusão e respeito aos direitos das pessoas migrantes, aprimorando o registro e atendimento dessa população no âmbito do SUS. Solicitamos especial atenção para o correto preenchimento do campo durante o atendimento, de forma a garantir dados fiéis e promover a qualidade dos serviços ofertados à população migrante.
Ressaltamos que, a partir de agora, a opção “nacionalidade = Brasil” também exigirá o preenchimento do campo “Situação do Migrante”. Nos casos de brasileiros não residentes, será obrigatório informar o país de residência.
Além disso, para pessoas que não possuem o campo “nacionalidade” preenchido no cadastro de PrEP ou Tarv, o campo “nacionalidade" estará disponível para preenchimento voluntário pelo farmacêutico/dispensador no ato da dispensação.
Para esclarecimentos adicionais ou maiores informações, utilize um dos canais de comunicação disponíveis:
| Atendimento relacionado aos Protocolos Clínicos e Diretrizes Terapêuticas | Atendimento relacionado à área de Controle de Medicamentos e Insumos do DATHI/SVSA/MS | Atendimento ao Usuário do SICLOM |
|
E-mail: tratamento@aids.gov.br e prevencao.hiv@aids.gov.br
|
E-mail: logistica@aids.gov.br
|
E-mail: siclom@aids.gov.br
|
Informe n° 23/2025 – Atualização de critérios para utilização e descontinuação do medicamento fostensavir 600mg - 24/10/2025
Prezados(as), boa tarde/dia!
Segue, em anexo, NOTA TÉCNICA Nº 221/2025-CGHA/.DATHI/SVSA/MS , de 22/10/2025, a qual dispõe da atualização de critérios para utilização e descontinuação do medicamento fostensavir 600 mg para tratamento de pessoas vivendo com HIV/aids (PVHA) com infecção por vírus multirresistente.
Convém solicitar apoio habitual para ampla divulgação.
Para esclarecimentos adicionais ou maiores informações, utilize um dos canais de comunicação disponíveis:
| Atendimento relacionado aos Protocolos Clínicos e Diretrizes Terapêuticas | Atendimento relacionado à área de Controle de Medicamentos e Insumos do DATHI/SVSA/MS | Atendimento ao Usuário do SICLOM |
|
E-mail: tratamento@aids.gov.br
|
E-mail: logistica@aids.gov.br
|
E-mail: siclom@aids.gov.br
|
Informe n° 22/2025 – Dispõe sobre a Nota Técnica n 200/2025 que amplia a faixa etária para uso da DFC composta por lamivudina 300mg/DTG 50mg - 16/09/2025
O Ministério da Saúde, por meio da Secretaria de Vigilância em Saúde e Ambiente e do seu Departamento de HIV e Aids, Tuberculose, Hepatites virais e Infecções Sexualmente Transmissíveis (DATHI), torna pública a Nota técnica 200/2025 que amplia a faixa etária para indicação da terapia dupla com a dose fixa combinada de lamivudina e dolutegravir e esclarece o ajuste de dose do dolutegravir em contextos de interação medicamentosa.
Solicitamos a ampla divulgação.
Para esclarecimentos adicionais ou maiores informações, utilize um dos canais de comunicação disponíveis:
| Atendimento relacionado aos Protocolos Clínicos e Diretrizes Terapêuticas | Atendimento relacionado à área de Controle de Medicamentos e Insumos do DATHI/SVSA/MS | Atendimento ao Usuário do SICLOM |
|
E-mail: tratamento@aids.gov.br
|
E-mail: logistica@aids.gov.br
|
E-mail: siclom@aids.gov.br
|
Informe n° 21/2025 – PrEP em duas etapas - 05/09/2025
Prezados(as)
O Siclom será atualizado para permitir o registro do formulário de dispensação do usuário sus em duas etapas, permitindo maior flexibilidade no atendimento. Essa atualização possibilitará que o processo seja concluído de acordo com a rotina da UDM, seja em dois momentos (consulta clínica e dispensação) ou em um único momento.
1ª Etapa – Registro da Prescrição: • A ficha poderá ser salva sem necessidade de conclusão imediata.
2ª Etapa – Registro de Lotes e Dispensa: • Realizada na farmácia pelo profissional responsável pela dispensação. • O profissional acessará a ficha salva e selecionará os lotes a serem dispensados. • O processo será concluído com a opção "Dispensar".
Cada UDM poderá escolher se o preenchimento da ficha ocorrerá em duas etapas (atendimento + dispensação) ou em uma única etapa, de acordo com sua rotina de trabalho. Para efetivar a dispensação, todos os campos obrigatórios deverão estar preenchidos. Essa atualização tem como objetivo ampliar a flexibilidade operacional das UDMs, garantindo maior compatibilidade às diferentes realidades de atendimento e dispensação de medicamentos.
Para esclarecimentos adicionais ou maiores informações, utilize um dos canais de comunicação disponíveis:
| Atendimento relacionado aos Protocolos Clínicos e Diretrizes Terapêuticas | Atendimento relacionado à área de Controle de Medicamentos e Insumos do DATHI/SVSA/MS | Atendimento ao Usuário do SICLOM |
|
E-mail: tratamento@aids.gov.br
|
E-mail: logistica@aids.gov.br
|
E-mail: siclom@aids.gov.br
|
Informe n° 20/2025 – Atualização Cadastral de Usuário SUS no SICLOM Operacional HIV - 05/09/2025
Prezados(as)
Com vistas a ampliar e qualificar o acesso à saúde de todas as populações, especialmente àquelas em situação de maior vulnerabilidade por meio dos dados obtidos pelo Siclom, ressalta-se a importância da constante atualização dos campos do "Cadastro do Usuário(a)".
Para que usuários (as) com cadastros desatualizados, incompletos ou pertencentes a situações de caráter provisório, o Campo de Atualização Cadastral estará disponível diretamente na tela de dispensação das categorias de Dispensa HIV/Aids, Gestante HIV+ e dispensa de PrEP.
Abaixo estão descritos os campos que poderão ser atualizados tanto no Cadastro do Usuário SUS quanto nas referidas telas de dispensação:
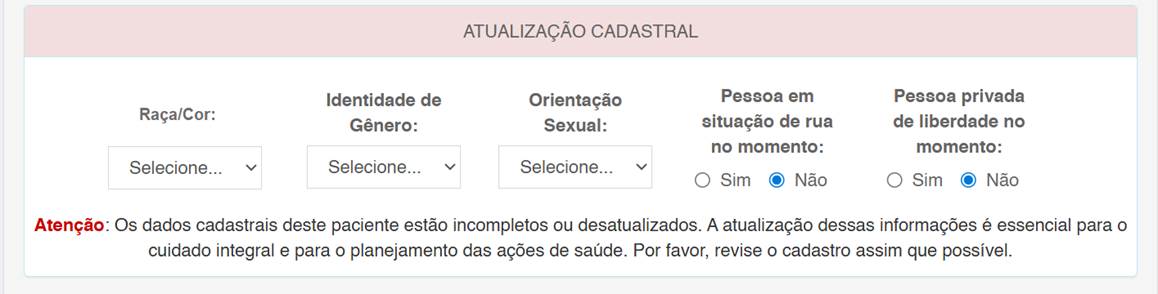
Para pessoas em situação de rua (PSR) ou pessoas privadas de liberdade (PPL), o sistema apresentará anualmente um aviso automático para conferência e atualização.
Para esclarecimentos adicionais ou maiores informações, utilize um dos canais de comunicação disponíveis:
| Atendimento relacionado aos Protocolos Clínicos e Diretrizes Terapêuticas | Atendimento relacionado à área de Controle de Medicamentos e Insumos do DATHI/SVSA/MS | Atendimento ao Usuário do SICLOM |
|
E-mail: tratamento@aids.gov.br
|
E-mail: logistica@aids.gov.br
|
E-mail: siclom@aids.gov.br
|
Informe n° 19/2025 – Atualização Cadastro de UDM - 05/09/2025
Prezados(as)
Na próxima atualização automática do SICLOM, que ocorre regularmente a cada 3 meses, será implementada uma melhoria no cadastro de Unidades Dispensadoras de Medicamentos (UDM).
Foram incluídos outros Tipos de Serviço com o objetivo de contemplar de forma abrangente a rede. Abaixo as opções: - Unidade de Saúde Prisional - Unidade de Urgência e Emergência - Organização da Sociedade Civil (OSC) - Serviços extramuros - Serviços de Atenção à População Trans - Farmácia central/polo municipal/estadual
Para esclarecimentos adicionais ou maiores informações, utilize um dos canais de comunicação disponíveis:
| Atendimento relacionado aos Protocolos Clínicos e Diretrizes Terapêuticas | Atendimento relacionado à área de Controle de Medicamentos e Insumos do DATHI/SVSA/MS | Atendimento ao Usuário do SICLOM |
|
E-mail: tratamento@aids.gov.br
|
E-mail: logistica@aids.gov.br
|
E-mail: siclom@aids.gov.br
|
Informe n° 18/2025 – Inventário Nacional de Agosto - 11/08/2025
ATENÇÃO!!!
Conforme acordado em reunião nacional com as equipes de logística de antirretrovirais (ARV), em agosto de 2025 deverá ser realizado o Inventário Nacional de Antirretroviral, Insumos de prevenção e Talidomida .
Dessa forma, o Mapa de Inventário de agosto/2025 ficará aberto entre os dias 1° e 2 de setembro de 2025, e deverá ser devidamente preenchido no SICLOM Operacional (UDM) e no Gerencial (Almoxarifado e MAT/URE).
Atenção para a obrigatoriedade no preenchimento dos lotes e prazos de validade no SICLOM Operacional (UDM) e no Gerencial (Almoxarifados e MATs/UREs).
Para esclarecimentos adicionais ou maiores informações, utilize um dos canais de comunicação disponíveis:
| Atendimento relacionado aos Protocolos Clínicos e Diretrizes Terapêuticas | Atendimento relacionado à área de Controle de Medicamentos e Insumos do DATHI/SVSA/MS | Atendimento ao Usuário do SICLOM |
|
E-mail: tratamento@aids.gov.br
|
E-mail: logistica@aids.gov.br
|
E-mail: siclom@aids.gov.br
|
Informe n° 17/2025 – Nota Técnica Conjunta nº 239/2025-CGAFME/DAF/SECTICS/MS e CGHA/DATHI/SVSA/MS - 22/07/2025
Encaminhamos a Nota Técnica Conjunta nº 239/2025-CGAFME/DAF/SECTICS/MS e CGHA/DATHI/SVSA/MS , que trata da disponibilização do medicamento dapsona 100 mg comprimido no âmbito do SUS, destinado à profilaxia da pneumocistose em pessoas vivendo com HIV/aids (PVHA).
A nota apresenta as indicações clínicas, os critérios de uso, os cuidados necessários para segurança das PVHA e o fluxo de distribuição do medicamento, que será realizado por meio de pautas quadrimestrais coordenadas pelo Ministério da Saúde. Reforça-se a importância da oferta do insumo nos serviços que atendem PVHA, especialmente nas Unidades Dispensadoras de Medicamentos (UDM) e nos Serviços de Atenção Especializada (SAE).
Solicitamos ampla divulgação junto às coordenações estaduais, municipais e aos serviços assistenciais.
Para dúvidas:
Sobre assistência farmacêutica e envio de pautas: micoses.cgafme@saude.gov.br
Sobre tratamento da infecção oportunista e PCDT: tratamento@aids.gov.br
Para explicações adicionais ou mais informações, utilize um dos canais de comunicação disponíveis:
| Atendimento relacionado aos Protocolos Clínicos e Diretrizes Terapêuticas | Atendimento relacionado à logística de medicamentos antirretrovirais | Suporte do SICLOM |
|
E-mail: tratamento@aids.gov.br
|
E-mail: logistica@aids.gov.br
|
E-mail: siclom@aids.gov.br
|
Para explicações adicionais ou mais informações, utilize um dos canais de comunicação disponíveis:
| Atendimento relacionado aos Protocolos Clínicos e Diretrizes Terapêuticas | Atendimento relacionado à logística de medicamentos antirretrovirais | Suporte do SICLOM |
|
E-mail: tratamento@aids.gov.br
|
E-mail: logistica@aids.gov.br
|
E-mail: siclom@aids.gov.br
|
Informe n° 15/2025 – Informe Técnico – Dispõe sobre recomendações para dispensação da apresentação do Darunavir 800mg – 18/07/2025
Contextualização
Por meio deste Informe, a Coordenação Geral de Vigilância do HIV e Aids (CGHA) do Departamento de HIV/Aids, Tuberculose, Hepatites Virais e Infecções Sexualmente Transmissíveis (Dathi/SVSA/MS) orienta a dispensação da apresentação do Darunavir 800mg. O Darunavir (DRV), antirretroviral da classe dos inibidores da protease (IP), desempenha papel fundamental no tratamento das pessoas vivendo com HIV e aids (PVHA), especialmente em razão de sua elevada barreira genética à resistência. Conforme o Protocolo Clínico e Diretrizes Terapêuticas (PCDT) para Manejo da Infecção pelo HIV em adultos (2024), recomenda-se o uso do darunavir 800mg em associação ao comprimido do ritonavir 100mg, uma vez ao dia, compondo esquemas antirretrovirais de primeira linha ou resgate inicial de primeira falha virológica sem mutações de resistência na protease.
Orientações
Considerando que os pedidos de ressuprimento da Programação Ascendente (PA) do medicamento antirretroviral Darunavir (DRV) 800mg, realizados por meio do Sistema de Controle Logístico de Medicamentos (SICLOM), não têm sido atendidos devido à indisponibilidade em estoque no almoxarifado central do Ministério da Saúde (MS), recomenda-se a adoção das seguintes medidas, em caráter excepcional e transitório: • Otimização dos estoques disponíveis e, quando necessária, restrição da dispensação do medicamento para um período máximo de 30 dias de tratamento; • Esgotamento das possibilidades de remanejamento local, visando maximizar o equilíbrio na disponibilidade do medicamento entre as unidades.
As novas entregas pelo MS estão previstas para ocorrerem até o final de julho de 2025, uma vez que o processo de aquisição encontra-se em fase final de contratação, com disponibilidade para pronta entrega pelos fornecedores, sendo possível a regularização das dispensações a partir de agosto de 2025. Importante ressaltar que as orientações apresentadas neste comunicado têm como objetivo apoiar os esforços das coordenações e equipes técnicas envolvidas na continuidade do tratamento dos usuários que fazem uso de DRV 800mg. Ressalta-se ainda que essas orientações poderão ser prontamente reavaliadas caso haja antecipação dos prazos previstos para o início das entregas ao MS, com o posterior envio imediato aos almoxarifados centrais dos estados.
Conclusão
Recomenda-se, portanto, a otimização dos estoques disponíveis de forma excepcional e transitória, de modo a garantir o uso regular do medicamento, e, uma vez restabelecidos os estoques, o departamento orienta o restabelecimento da dispensação para 90 dias, conforme as pactuações prévias.
Para esclarecimentos adicionais ou maiores informações, utilize um dos canais de comunicação disponíveis:
| Atendimento relacionado aos Protocolos Clínicos e Diretrizes Terapêuticas | Atendimento relacionado à logística de medicamentos antirretrovirais | Atendimento ao Usuário(a) do SICLOM |
|
E-mail: tratamento@aids.gov.br
|
E-mail: logistica@aids.gov.br
|
E-mail: siclom@aids.gov.br
|
Informe n° 14/2025 – Informe Técnico – Novo Ressuprimento Mensal no SICLOM Operacional – 01/07/2025
Prezadas(os),
Está disponível o vídeo explicativo sobre a nova funcionalidade de Ressuprimento Mensal no sistema SICLOM Operacional. Essa nova funcionalidade tem como objetivo otimizar o processo de solicitação e gestão de medicamentos no âmbito do SUS, promovendo mais agilidade, padronização e controle nas rotinas mensais. ▶️ Assista ao vídeo demonstrativo: Novo Ressuprimento Mensal
Principais pontos abordados no vídeo: • Visão geral da nova funcionalidade • Como acessar o módulo de ressuprimento mensal
Contamos com a atenção de todos(as) para o conteúdo, pois o novo Ressuprimento Mensal já está em funcionamento e substituirá o SICLOM Gerencial a partir de agosto de 2025.
Em caso de dúvidas, entre em contato com o suporte técnico por meio dos canais de atendimento disponíveis.
Solicitamos ampla divulgação.
Para esclarecimentos adicionais ou maiores informações, utilize um dos canais de comunicação disponíveis:
| Atendimento relacionado aos Protocolos Clínicos e Diretrizes Terapêuticas | Atendimento relacionado à área de Controle de Medicamentos e Insumos do DATHI/SVSA/MS | Atendimento ao Usuário(a) do SICLOM |
|
E-mail: tratamento@aids.gov.br
|
E-mail: logistica@aids.gov.br
|
E-mail: siclom@aids.gov.br
|
Informe n° 13/2025 – Ressuprimento Mensal - 26/05/2025
Prezados Responsáveis pela Logística de Antirretrovirais e Dispensadores,
Como estratégia de aprimoramento contínuo do Sistema de Controle Logístico de Medicamentos (SICLOM), informamos que algumas adaptações serão implementadas no próximo mês, com previsão de conclusão em julho.
Será criado, no SICLOM Operacional, uma nova opção chamada Ressuprimento Mensal no menu Estoque, onde estarão reunidas funcionalidades anteriormente disponíveis no SICLOM Gerencial. Nesse novo menu, serão migrados os instrumentos Mapa Mensal, Boletim Mensal e Programação Ascendente, otimizando o processo de registro, conferência e planejamento das Unidades Dispensadoras de Medicamentos (UDM).
Detalharemos as mudanças a seguir:
Boletim Mensal para a Avaliação de Uso de Medicamentos/Aids
O Boletim Mensal para a Avaliação de Uso de Medicamentos/Aids, anteriormente disponível no SICLOM Gerencial, será migrado para o SICLOM Operacional.
Na nova versão, não será mais possível realizar ajustes diretamente no boletim, e também não será necessário acessar o detalhamento dos medicamentos para conferência.
O sistema continuará apresentando o consolidado das dispensações de medicamentos por modalidade de usuário, conforme registrado ao longo do mês. Caso os dados estejam corretos, o responsável pelo preenchimento deverá apenas confirmar as informações clicando no botão Fechar BOLETIM.
Se forem identificadas inconsistências, o dispensador deverá revisar as dispensações realizadas no mês de referência e, caso alguma esteja ausente, acessar o menu correspondente à dispensação e registrar a movimentação com data retroativa, correspondente à data real do atendimento. Dessa forma, o sistema atualizará automaticamente os dados no boletim após a inserção correta da informação.
Mapa de Movimento Mensal de Medicamentos/Aids
O Mapa de Movimento Mensal de Medicamentos/Aids, anteriormente disponível no SICLOM Gerencial e no menu Estoque do SICLOM Operacional, será migrado para a nova opção Ressuprimento Mensal no SICLOM Operacional.
Nessa nova versão, os campos consolidados do mapa não poderão mais ser editados manualmente. Apenas os campos de Ajuste de Entrada e Ajuste de Saída permanecerão disponíveis para edição, permitindo correções pontuais de estoque, quando devidamente justificadas.
Os demais campos — como dispensações, saídas para paciente internado, perdas, entre outros — estarão bloqueados para edição direta. Essa mudança tem como objetivo assegurar que o preenchimento do mapa reflita exclusivamente os registros realizados nos menus apropriados do sistema. Concluída a análise e gravação dos dados de cada medicamento, o responsável deverá confirmar as informações clicando no botão Fechar Mapa.
Se forem identificadas inconsistências, o dispensador deverá revisar as movimentações de estoque registradas no mês de referência. Caso alguma informação precise ser corrigida — por exemplo, uma dispensação não registrada — será necessário acessar o menu correspondente à movimentação e realizar o registro com a data retroativa, respeitando a data real do evento. O sistema atualizará automaticamente os dados do mapa mensal com base nas movimentações corrigidas.
Essa nova sistemática é fundamental para assegurar a consistência dos dados, refletir com fidelidade a movimentação real dos estoques, garantir a integridade do histórico terapêutico do usuário do SUS e garantir a precisão dos pedidos de ressuprimento em nível local e estadual.
Pedido de Ressuprimento
A Programação Ascendente (PA) também será migrada do SICLOM Gerencial para o SICLOM Operacional. Com essa mudança, após o fechamento do Mapa de Movimento Mensal e do Boletim Mensal de Medicamentos, o responsável poderá registrar o pedido diretamente no módulo de Ressuprimento Mensal do SICLOM Operacional.
A lógica de funcionamento do Pedido de Ressuprimento permanece inalterada, sendo mantidos os critérios e cálculos já adotados. A principal mudança está no layout da tela, que foi redesenhado para proporcionar uma navegação mais intuitiva e eficiente.
Essa integração visa simplificar o fluxo de trabalho, centralizando as funcionalidades em um único ambiente e promovendo maior agilidade, rastreabilidade e padronização no processo de solicitação de medicamentos.
Cumpre reiterar que o prazo para preenchimento desses instrumentos pelas UDM deve ser acordado entre as coordenações e equipes de logística. O prazo para o pedido de ressuprimento pelas secretarias estaduais permanece inalterado, devendo ser realizado até o dia 10 (dez) de cada mês.
Ainda em junho, o preenchimento dessas etapas poderá ser realizado tanto no Siclom operacional quanto no gerencial. A partir de julho, o preenchimento será feito em sua totalidade somente na versão operacional.
Essas alterações se aplicam exclusivamente às UDMs, os demais pontos da rede permanecem com seus fluxos operacionais inalterados.
Seguimos à disposição para prestar quaisquer esclarecimentos adicionais que se fizerem necessários.
Atenciosamente,
| Atendimento relacionado à área de Controle de Medicamentos e Insumos do DATHI/SVSA/MS | Atendimento ao Usuário(a) do SICLOM |
|
E-mail: logistica@aids.gov.br
|
E-mail: siclom@aids.gov.br
|
Informe n° 12/2025 – Revogação informe 11/2025 – 14/05/2025
Prezados(as),
A política nacional de enfrentamento da Aids tem reforçado seu compromisso com o acesso universal, gratuito e contínuo ao tratamento antirretroviral. Entre outras medidas, a validade do formulário de prescrição foi ampliada de 90 para 180 dias, evitando com isso interrupções do tratamento. Esta medida enfrentou resistência por parcela dos profissionais de saúde – especialmente entre médicos - que desejavam vincular a frequência das consultas ao tempo de fornecimento do tratamento antirretroviral: o posicionamento em estabelecer a priorização do cuidado centrado na pessoa, fez com que o Dathi mantivesse esta orientação.
A dispensação de medicamentos antirretrovirais requer prescrição emitida por profissional legalmente habilitado, conforme atribuições definidas pelos respectivos conselhos de classe. A realização de exames laboratoriais e avaliação clínica constituem prática essencial para garantir qualidade no cuidado e do tratamento.
A avaliação clínico laboratorial periódica pode evitar situações que representam risco potencial às pessoas vivendo com HIV/Aids (PVHA), tais como:
a) Uso prolongado de esquemas obsoletos sem reavaliação médica;
b) Manutenção do esquema na presença de falha virológica, com acúmulo de mutações de resistência que podem comprometer a estruturação de esquemas de resgate;
c) Desenvolvimento de eventos adversos potencialmente graves, como insuficiência renal, sem identificação precoce pela equipe de saúde.
Considerando esse contexto, foi publicado o informe 11/2025 que incluiu uma crítica não impeditiva da dispensação dos medicamentos, para orientar que o prazo entre prescrição e fornecimento dos antirretrovirais não exceda 6 meses, limite temporal máximo que os Protocolos Clínicos recomendam para nova avaliação clínica e laboratorial. Devido a reações e manifestações após a publicação do informe, o Departamento de HIV/Aids, Tuberculose, Hepatites Virais e Infecções Sexualmente Transmissíveis (Dathi/SVSA/MS) decidiu revogar o informe 11/2025, retirando a crítica do Sistema de Controle Logístico de Medicamentos (SICLOM), relacionada à dispensação de medicamentos antirretrovirais em prescrições com mais de 180 dias desde sua emissão. Cabe destacar a importância em garantir a oferta regular de consultas e exames laboratoriais, sob responsabilidade de estados e municípios.
Atenciosamente,
| Atendimento relacionado aos Protocolos Clínicos e Diretrizes Terapêuticas | Atendimento relacionado à área de Controle de Medicamentos e Insumos do DATHI/SVSA/MS | Atendimento ao Usuário(a) do SICLOM |
|
E-mail: tratamento@aids.gov.br
|
E-mail: logistica@aids.gov.br
|
E-mail: siclom@aids.gov.br
|
Informe n° 10/2025 – Nota Técnica nº Nº 128/2025-CGHA/.DATHI/SVSA/MS – 13/05/2025
Segue a Nota Informativa n° 128/2025-CGHA/.DATHI/SVSA/MS, que trata de orientações sobre a reintegração de medicamentos antirretrovirais devolvidos por usuários ao estoque das unidades dispensadoras.
Solicitamos ampla divulgação.
Para esclarecimentos adicionais ou maiores informações, utilize um dos canais de comunicação disponíveis:
| Atendimento relacionado aos Protocolos Clínicos e Diretrizes Terapêuticas | Atendimento relacionado à área de Controle de Medicamentos e Insumos do DATHI/SVSA/MS | Atendimento ao Usuário(a) do SICLOM |
|
E-mail: tratamento@aids.gov.br
|
E-mail: logistica@aids.gov.br
|
E-mail: siclom@aids.gov.br
|
Informe n° 09/2025 – Nota Informativa nº 91/2025-CGHA/.DATHI/SVSA/MS – 23/04/2025
Segue a Nota Informativa n° 91/2025 – CGHA/DATHI/SVSA/MS, de 17/04/2025, que atualiza os critérios para a oferta da apresentação em dose fixa combinada de lamivudina e dolutegravir 300 mg + 50 mg para pessoas vivendo com HIV ou aids em tratamento no SUS e revoga a Nota Técnica nº214/2024-CGHA/DATHI/SVSA/MS.
Solicitamos ampla divulgação.
Para esclarecimentos adicionais ou maiores informações, utilize um dos canais de comunicação disponíveis:
| Atendimento relacionado aos Protocolos Clínicos e Diretrizes Terapêuticas | Atendimento relacionado à área de Controle de Medicamentos e Insumos do DATHI/SVSA/MS | Atendimento ao Usuário(a) do SICLOM |
|
E-mail: tratamento@aids.gov.br
|
E-mail: logistica@aids.gov.br
|
E-mail: siclom@aids.gov.br
|
Informe n° 08/2025 – Nota Informativa nº 2/2025/CGAHV/.DATHI/SVSA/MS - 28/03/2025
Segue a Nota Informativa n° 2/2025 – CGHA/DATHI/SVSA/MS, de 24/03/2025, que revogação da NOTA INFORMATIVA Nº 5/2024-CGHA/.DATHI/SVSA/MS, de 7/8/2024, a partir da normalização do estoque da dose fixa combinada (DFC) do medicamento antirretroviral Tenofovir (TDF) 300mg + Lamivudina (3TC) 300mg + Efavirenz (EFZ) 600mg (TDF/3TC/EFZ).
Solicitamos ampla divulgação.
Para esclarecimentos adicionais ou maiores informações, utilize um dos canais de comunicação disponíveis:
| Atendimento relacionado aos Protocolos Clínicos e Diretrizes Terapêuticas | Atendimento relacionado à área de Controle de Medicamentos e Insumos do DATHI/SVSA/MS | Atendimento ao Usuário(a) do SICLOM |
|
E-mail: tratamento@aids.gov.br
|
E-mail: logistica@aids.gov.br
|
E-mail: siclom@aids.gov.br
|
Informe n° 07/2025 – Disponibilização do Manual de Referência do SICLOM Operacional - 26/03/2025
Informamos que o Guia de Referência SICLOM Operacional, está disponível para consulta. Este material tem como objetivo orientar os usuários sobre as funcionalidades do sistema SICLOM, abordando os principais processos operacionais e garantindo um melhor aproveitamento da ferramenta.
O guia pode ser acessado no Menu Documentos do SICLOM Gerencial.
Reforçamos a importância da leitura e compreensão do material para o correto uso do sistema. Em caso de dúvidas ou necessidade de suporte, entre em contato com a nossa equipe.
Solicitamos ampla divulgação.
Para esclarecimentos adicionais ou maiores informações, utilize um dos canais de comunicação disponíveis:
| Atendimento relacionado aos Protocolos Clínicos e Diretrizes Terapêuticas | Atendimento relacionado à área de Controle de Medicamentos e Insumos do DATHI/SVSA/MS | Atendimento ao Usuário(a) do SICLOM |
|
E-mail: tratamento@aids.gov.br
|
E-mail: logistica@aids.gov.br
|
E-mail: siclom@aids.gov.br
|
Informe n° 06/2025 – Nota Técnica nº 48/2025/CGAHV/.DATHI/SVSA/MS - 17/02/2025
Segue, em anexo, Nota Técnica n° 48/2025 – CGHA/DATHI/SVSA/MS, de 13/2/2025, que dispõe sobre a descontinuidade do medicamento Efavirenz (EFV) nas apresentações de solução oral (de 30mg/ml) e comprimido revestido de 600mg e 200mg do elenco terapêutico de antirretrovirais no SUS e reforça orientações sobre esquemas antirretrovirais preferenciais para manutenção do tratamento em adultos e crianças vivendo com HIV ou aids em uso dessas apresentações.
Solicitamos ampla divulgação.
Para esclarecimentos adicionais ou maiores informações, utilize um dos canais de comunicação disponíveis:
| Atendimento relacionado aos Protocolos Clínicos e Diretrizes Terapêuticas | Atendimento relacionado à área de Controle de Medicamentos e Insumos do DATHI/SVSA/MS | Atendimento ao Usuário(a) do SICLOM |
|
E-mail: tratamento@aids.gov.br
|
E-mail: logistica@aids.gov.br
|
E-mail: siclom@aids.gov.br
|
Informe n° 05/2025 – Nota Técnica nº 46/2025/CGAHV/.DATHI/SVSA/MS - 17/02/2025
Segue, em anexo, Nota Técnica n° 46/2025 – CGHA/DATHI/SVSA/MS, de 11/2/2025, que dispõe sobre a descontinuidade definitiva do medicamento Enfuvirtida (Fuzion®) do elenco de medicamentos antirretrovirais dispensados no âmbito do SUS e orientações sobre sua substituição em Pessoas Vivendo com HIV/Aids (PVHA).
Solicitamos ampla divulgação.
Para esclarecimentos adicionais ou maiores informações, utilize um dos canais de comunicação disponíveis:
| Atendimento relacionado aos Protocolos Clínicos e Diretrizes Terapêuticas | Atendimento relacionado à área de Controle de Medicamentos e Insumos do DATHI/SVSA/MS | Atendimento ao Usuário(a) do SICLOM |
|
E-mail: tratamento@aids.gov.br
|
E-mail: logistica@aids.gov.br
|
E-mail: siclom@aids.gov.br
|
Informe n° 04/2025 – Nota Técnica nº 29/2025-CGHA/.DATHI/SVSA/MS - 03/02/2025
Segue a Nota Técnica n° 29/2025/ CGHA/.DATHI/SVSA/MS, que trata sobre as orientações da transição da apresentação do medicamento etravirina 100mg para etravirina 200mg para compor esquema antirretroviral pediátrico.
Solicitamos ampla divulgação e colocamo-nos à disposição para prestar quaisquer informações adicionais que se fizerem necessárias, por meio dos canais:
| Atendimento relacionado aos Protocolos Clínicos e Diretrizes Terapêuticas | Atendimento relacionado à área de Controle de Medicamentos e Insumos | Atendimento ao Usuário(a) do SICLOM |
|
E-mail: tratamento@aids.gov.br
|
E-mail: logistica@aids.gov.br
|
E-mail: siclom@aids.gov.br
|
Informe n° 03/2025 – Inclusão do medicamento Fostensavir 600mg na Programação Ascendente do Siclom HIV de fev/2025- 27/01/2025
Inicialmente, vale registrar que o Dathi realizou o cadastramento da 1ª grade de distribuição de Fostensavir 600mg na Programação Ascendente (PA) do módulo gerencial do Sistema de Controle Logístico de Medicamentos (SICLOM HIV), referente ao período de ressuprimento de jan/2025.
A partir de 1º de fevereiro de 2025, o medicamento será incluído na PA do Siclom HIV Gerencial e seguirá o fluxo normal de pedido adotado para os demais antirretrovirais (ARV) disponibilizados pelo Ministério da Saúde (MS), com a particularidade de que o "Consumo projetado" será calculado com base (1) na média de consumo registrado no Boletim Mensal para Avaliação e Uso de Medicamentos dos últimos três meses e (2) no consumo autorizado pelo Sistema Laudo, ou seja, para cada paciente autorizado, o sistema adicionará 60 comprimidos ao resultado da média de consumo no último trimestre. Dessa forma, o fator de ajuste para esse item na PA não será considerado para o cálculo automático da "Sugestão de Pedido".
Importante ressaltar que as "coberturas acordadas" na PA serão mantidas para cada coordenação, Unidade Dispensadora de Medicamentos (UDM) e demais serviços integrantes da rede de ressuprimento de ARV, tanto para a "Sugestão de Pedido" quanto para o "Pedido" e o processo de aprovação do Fostensavir 600mg pela PA.
Para esclarecimentos adicionais ou maiores informações, utilize um dos canais de comunicação disponíveis:
| Atendimento | Canais de comunicação |
|---|---|
| Avaliação e autorização de uso de Fostensavir 600mg |
E-mail: fostensavir@aids.gov.br
|
| Protocolos Clínicos e Diretrizes Terapêuticas (PCDT) |
E-mail: tratamento@aids.gov.br
|
| Logística de Medicamentos antirretrovirais |
E-mail: logistica@aids.gov.br
|
| Suporte SICLOM |
E-mail: siclom@aids.gov.br
|
Informe n° 02/2025 – Inclusão do Fostensavir no sistema LAUDO e procedimentos para solicitação- 07/01/2025
Prezados/as,
O Departamento de HIV/AIDS, Tuberculose, Hepatites Virais e Infecções Sexualmente Transmissíveis, através da Coordenação Geral de Vigilância do HIV/Aids (CGHA/DA-THI/SVSA/MS) publica o OFÍCIO Nº 27/2025/CGHA/.DATHI/SVSA/MS (com os anexos: Anexo A , Anexo B , Anexo C ) que dispõe sobre a Inclusão do antirretroviral Fostensavir 600mg no Sistema Laudo e procedimentos para solicitação e avaliação.
Solicitamos ampla divulgação e colocamo-nos à disposição para informações adicionais.
| Atendimento relacionado aos Protocolos Clínicos e Diretrizes Terapêuticas | Atendimento relacionado à área de Controle de Medicamentos e Insumos | Atendimento ao Usuário(a) do SICLOM |
|
E-mail: tratamento@aids.gov.br
|
E-mail: logistica@aids.gov.br
|
E-mail: siclom@aids.gov.br
|
Informe n° 01/2025 – Critérios para utilização do Fostensavir - 06/01/2025
Prezados/as,
Segue a Nota Técnica n° 39/2024-Dathi/SVSA/MS, que estabelece os critérios para a utilização do antirretroviral fostensavir 600mg no tratamento de adultos vivendo com HIV multirresistente a antirretrovirais.
Para esclarecimentos adicionais ou mais informações, utilize um dos canais de comunicação disponíveis:
| Atendimento relacionado aos Protocolos Clínicos e Diretrizes Terapêuticas | Atendimento relacionado à área de Controle de Medicamentos e Insumos | Atendimento ao Usuário(a) do SICLOM |
|
E-mail: tratamento@aids.gov.br
|
E-mail: logistica@aids.gov.br
|
E-mail: siclom@aids.gov.br
|
Informe n° 33/2024 – Atualização do formulário de PEP - 26/11/2024
Prezados(as),
Informamos que o Formulário de Solicitação de Medicamentos PEP foi revisado e atualizado, e a nova versão de Outubro de 2024 encontra-se disponível na aba de documentos>>formulários do Siclom gerencial. As alterações visam propiciar maior clareza e precisão no preenchimento pelo profissional prescritor e no registro da informação no Siclom pelo dispensador, atender de forma mais abrangente os diferentes perfis e situações de usuários e alinhar o formulário às normas vigentes e às melhores práticas no atendimento de PEP. Informa-se, ainda, que a nova versão foi atualizada, também, no Siclom logístico/operacional.
Assim, solicita-se ampla divulgação do novo formulário.
Para esclarecimentos adicionais ou mais informações, utilize um dos canais de comunicação disponíveis:
| Atendimento relacionado à área de prevenção do HIV/Aids | Atendimento ao Usuário(a) do SICLOM |
|
E-mail: prevencao.hiv@aids.gov.br
|
E-mail: siclom@aids.gov.br
|
Informe n° 32/2024 – Atualização da Ficha de Atendimento para PrEP- 26/11/2024
Prezados/as Coordenadores/as e dispensadores/as,
Informamos que a ficha de atendimento da PrEP foi atualizada para atender as atualizações do Protocolo Clínico e Diretrizes Terapêuticas para Profilaxia Pré-Exposição (PrEP) Oral à Infecção pelo HIV Com a publicação do formulário será possível ampliar o intervalo das consultas para 180 dias, desde que seguidas as orientações do PCDT e a dispensa para esse período dependerá da disponibilidade local da UDM.
| Atendimento relacionado à área de prevenção do HIV/Aids | Atendimento ao Usuário(a) do SICLOM |
|
E-mail: prevencao.hiv@aids.gov.br
|
E-mail: siclom@aids.gov.br
|
Informe n° 31/2024 – Sobre uso dos navegadores de internet preferenciais - 25/09/2024
Prezados(as) usuários(as),
Informamos que, para melhor funcionamento do SICLOM Gerencial e Operacional, recomendamos a utilização dos navegadores Google Chrome ou Mozilla Firefox. Pedimos que NÃO utilizem o navegador Microsoft Edge, uma vez que ele apresenta instabilidades e comprometimento das funcionalidades do sistema.
Agradecemos a compreensão e colaboração de todos.
Solicita-se ampla divulgação.
Para esclarecimentos adicionais ou mais informações, utilize um dos canais de comunicação disponíveis:
| Atendimento relacionado aos Protocolos Clínicos e Diretrizes Terapêuticas | Atendimento relacionado à área de Controle de Medicamentos e Insumos | Atendimento ao Usuário(a) do SICLOM |
|
E-mail: tratamento@aids.gov.br
|
E-mail: logistica@aids.gov.br
|
E-mail: siclom@aids.gov.br
|
Informe n° 30/2024 – NOTA TECNICA Nº 214/2024-CGHA/.DATHI/SVSA/MS – 11/09/2024
Em conformidade com a Nota Técnica Nº 214/2024, o Departamento de HIV, Aids, Tuberculose, Hepatites Virais e Infecções Sexualmente Transmissíveis (DATHI/SVSA/MS), por meio da Coordenação Geral de Vigilância do HIV/Aids (CGHA/ DATHI/SVSA/MS), atualiza as recomendações referentes à terapia antirretroviral dupla de dose fixa combinada (DFC) de lamivudina 300mg e Dolutegravir 50mg, a ser administrada em um único comprimido diário. Esta orientação visa proporcionar um tratamento com maior comodidade e segurança para as Pessoas Vivendo com HIV ou Aids (PVHA), especialmente aquelas com maior risco de complicações renais e ósseas.
O SICLOM estará em conformidade com a nota técnica a partir do dia 12/09/2024 (amanhã).
Solicita-se ampla divulgação, especialmente com os profissionais envolvidos no cuidado da PVHA.
Para esclarecimentos adicionais ou mais informações, utilize um dos canais de comunicação disponíveis:
| Atendimento relacionado aos Protocolos Clínicos e Diretrizes Terapêuticas | Atendimento relacionado à área de Controle de Medicamentos e Insumos | Atendimento ao Usuário(a) do SICLOM |
|
E-mail: tratamento@aids.gov.br
|
E-mail: logistica@aids.gov.br
|
E-mail: siclom@aids.gov.br
|
Informe n° 29/2024 – NOTA TÉCNICA Nº 204/2024-CGHA/.DATHI/SVSA/MS – 03/09/2024
Prezados/as,
Segue a NOTA TÉCNICA Nº 204/2024-CGHA/.DATHI/SVSA/MS, que dispõe sobre as orientações dos esquemas antirretrovirais preferenciais e alternativos para pessoas vivendo com HIV ou aids em uso de tenofovir desoproxila 300 mg comprimido monofármaco.
Solicita-se ampla divulgação.
Para esclarecimentos adicionais ou mais informações, utilize um dos canais de comunicação disponíveis:
| Atendimento relacionado aos Protocolos Clínicos e Diretrizes Terapêuticas | Atendimento relacionado à área de Controle de Medicamentos e Insumos | Atendimento ao Usuário(a) do SICLOM |
|
E-mail: tratamento@aids.gov.br
|
E-mail: logistica@aids.gov.br
|
E-mail: siclom@aids.gov.br
|
Informe n° 28/2024 – NOTA TÉCNICA Nº 197/2024-CGHA/.DATHI/SVSA/MS – 23/08/2024
Prezados/as,
Segue a Nota Técnica que Dispõe sobre as recomendações sobre o uso do autoteste de HIV para início da Profilaxia Pós-Exposição (PEP) ao HIV.
Solicita-se ampla divulgação.
Para esclarecimentos adicionais ou mais informações, utilize um dos canais de comunicação disponíveis:
| Atendimento relacionado aos Protocolos Clínicos e Diretrizes Terapêuticas | Atendimento relacionado à área de Controle de Medicamentos e Insumos | Atendimento ao Usuário(a) do SICLOM |
|
E-mail: tratamento@aids.gov.br
|
E-mail: prevencao@aids.gov.br
|
E-mail: siclom@aids.gov.br
|
Informe n° 27/2024 – Orientações para o Recebimento de Insumos Estratégicos de Saúde (IES): Procedimentos e Responsabilidades. - 22/08/2024
O Departamento de Logística em Saúde – DLOG/SE/MS constatou que os procedimentos de recepção das cargas de IES não estão sendo cumpridos integralmente pelos destinatários, ocasionando falhas processuais decorrentes da ausência de documentos, do preenchimento parcial dos comprovantes de recebimento, da demora em comunicar a não conformidade dos IES, entre outros.
Assim, para prevenir falhas na gestão de IES e garantir o correto recebimento dos insumos, os servidores e colaboradores qualificados que atuam nas operações de recebimento das cargas, no momento de recepcionar os IES, devem:
a. no ato da entrega, inspecionar os insumos acondicionados nas embalagens e, constatada a conformidade, recebê-los;
b. verificar se os insumos correspondem ao descrito na Nota de Fornecimento de Medicamento e no “Documento Auxiliar do Conhecimento de Transporte Eletrônico - DACTE”, o que inclui conferir os códigos e as especificações;
c. no recebimento, identificar eventuais faltas, excursões de temperatura, avarias, divergências ou violações nas embalagens/insumos, ou rejeitar o recebimento dos insumos;
d. inspecionar visualmente os insumos para verificar se há danos (mofado, rasgado, amassado, molhado etc) e, caso encontre algum problema, registrar a ocorrência;
e. fotografar a eventual não conformidade das embalagens e dos insumos;
f. registrar as reclamações sobre a carga no ato do recebimento dos IES, usando a própria Nota de Fornecimento de Medicamento, datando, anotando a hora, apondo carimbo com cargo e matrícula e assinando;
g. entrar em contato pelo e-mail sadm.transporte@saude.gov.br, se for identificada alguma divergência no ato do recebimento;
h. preencher o “Formulário de Entrega de Carga” nos campos específicos, descrevendo as condições das embalagens e dos insumos; escrever o nome legível, datar, anotar a hora, apor carimbo com cargo e matrícula e assinar; e
i. preencher o check-list que acompanha a carga, devendo restituí-lo juntamente com todos os comprovantes dos serviços prestados pela empresa de transporte.
Ressalta-se que os Insumos Estratégicos de Saúde não devem ser recebidos se as embalagens apresentarem sinais de violação, aderência ao insumo, umidade ou inadequação em relação ao conteúdo e se não estiverem devidamente identificadas.
Ainda, se o destinatário se recusar a verificar a carga no ato da entrega, a contratada para realizar a entrega poderá/deverá informar no verso do Conhecimento de Transporte acerca da recusa e solicitar a manifestação e a assinatura do destinatário.
Constatada a regularidade do transporte, após a conferência dos bens acondicionados nos volumes pelo destinatário, cessará, nesse momento, a responsabilidade da contratada pela integridade dos volumes entregues, sendo que o destinatário assinará o aceite da entrega no campo específico do Conhecimento de Transporte.
Informa-se que tais medidas visam otimizar a gestão e os processos de armazenagem e transporte dos Insumos Estratégicos de Saúde – IES no âmbito do Sistema Único de Saúde.
Para esclarecimentos adicionais ou mais informações, utilize um dos canais de comunicação disponíveis:
| Agendamento das entregas e transporte dos medicamentos e insumos estratégicos para saúde do Ministério da Saúde | Atendimento relacionado à área de Controle de Medicamentos e Insumos (grupo Testes Rápidos) do DATHI/SVSA/MS |
|
E-mails: cglog.agendamento@saude.gov.br e
|
E-mail: logistica.prevencao@aids.gov.br
|
Informe n° 26/2024 – Nota Informativa n° 05/2024/DATHI/SVSA/MG - Substituição temporária e excepcional de TDF/3TC/EFZ por TDF/3TC + EFZ - 08/08/2024
Prezados coordenadores e responsáveis pela logística de ARV!
Segue anexa a Nota Informativa Nº 05/2024-CGHA/.DATHI/SVSA/MG, de 7/8/2024, a qual dispõe em caráter excepcional e transitório, sobre as recomendações para substituição temporária da dose fixa combinada (DFC) do medicamento tenofovir/lamivudina/efavirenz 300mg/300mg/600mg pela DFC de tenofovir/lamivudina 300mg/300mg (TDF/3TC) e efavirenz 600mg (EFV) monofármaco para pessoas vivendo com HIV/aids (PVHA).
O Sistema de Controle Logístico de Medicamentos (SICLOM) estará habilitado de acordo com os critérios indicados nesta nota a partir de amanhã , dia 09/08/2024.
Para esclarecimentos adicionais ou mais informações, utilize um dos canais de comunicação disponíveis:
| Atendimento relacionado aos Protocolos Clínicos e Diretrizes Terapêuticas | Atendimento relacionado à área de Controle de Medicamentos e Insumos do DATHI/SVSA/MS | Atendimento ao Usuário do SICLOM |
|
E-mail: tratamento@aids.gov.br
|
E-mail: logistica@aids.gov.br
|
E-mail: siclom@aids.gov.br
|
Informe n° 25/2024 – Atualização do Formulário de Solicitação de Medicamentos – Tratamento para Crianças – 08/08/2024.
Prezados/as Coordenadores/as, Responsáveis pela Logística de Antirretrovirais, e dispensadores/as,
Em razão do aprimoramento contínuo nas ações de assistência às crianças vivendo com HIV/Aids (CVHA) em terapia antirretroviral, informa-se que está disponível na aba de documentos>>formulários do Siclom gerencial o formulário atualizado de solicitação de medicamentos – Tratamento – Criança. Dessa forma, o novo formulário e o Siclom operacional foram ajustados de modo a atender aos seguintes critérios:
1. O abacavir (ABC) deve ser iniciado após o resultado de HLA*B5701.
A indisponibilidade do exame não deve postergar o início de TARV, devendo ser realizado com esquemas alternativos.
2. O tenofovir (TDF) comprimido de 300mg está recomendado apenas para crianças a partir de 35kg.
3. O efavirenz (EFZ) e nevirapina (NVP), devem ser considerados como tratamento alternativo às crianças vivendo com HIV, conforme recomendações do Protocolo Clínico e Diretrizes Terapêuticas Manejo da Infecção pelo HIV em Crianças e Adolescentes (2023) e suas atualizações.
As alterações no SICLOM estarão disponíveis amanhã , dia 09/08/2024.
Solicitamos ampla divulgação do formulário, especialmente com as unidades ambulatoriais e unidades dispensadoras de medicamentos.
Para esclarecimentos adicionais ou mais informações, utilize um dos canais de comunicação disponíveis:
| Atendimento relacionado aos Protocolos Clínicos e Diretrizes Terapêuticas | Atendimento relacionado à área de Controle de Medicamentos e Insumos do DATHI/SVSA/MS | Atendimento ao Usuário do SICLOM |
|
E-mail: tratamento@aids.gov.br
|
E-mail: logistica@aids.gov.br
|
E-mail: siclom@aids.gov.br
|
Informe n° 24/2024 – Inventário Nacional de Antirretroviral, Insumos de Prevenção e Talidomida – 23/07/2024
Conforme acordado em reunião nacional com as equipes de logística de antirretrovirais (ARV), em agosto de 2024 deverá ser realizado o Inventário Nacional de Antirretroviral, Talidomida e Insumos de Prevenção.
Dessa forma, o Mapa de Inventário de agosto/2024 ficará aberto do dia 30/08/2024 até o dia 2/9/2024 (segunda-feira), e deverá ser devidamente preenchido no SICLOM Operacional (UDM) e no Gerencial (Almoxarifados e MAT/URE).
Os procedimentos permanecem inalterados, com destaque para (1) a obrigatoriedade de preenchimento dos lotes e prazos de validade pelos usuários que ainda não utilizam o SICLOM Operacional e (2) o fechamento do Mapa de Inventário exclusivamente pelo SICLOM Operacional quando realizar ajuste de estoque no SICLOM Operacional, pois os ajustes feitos no SICLOM Gerencial não serão refletidos automaticamente no estoque do SICLOM Operacional.
Informe – Inventário Nacional de ARV e Talidomida – Ago/24
Para esclarecimentos adicionais ou mais informações, utilize um dos canais de comunicação disponíveis:
| Atendimento relacionado à área de Controle de Medicamentos e Insumos do DATHI/SVSA/MS | Atendimento ao Usuário do SICLOM |
|
E-mail: logistica@aids.gov.br
|
E-mail: siclom@aids.gov.br
|
Informe n° 23/2024 – Levantamento da disponibilidade de medicamentos para tratamento preventivo da tuberculose (TPT ou tratamento da ILTB) e esquema básico da tuberculose nas Unidades Dispensadoras de Medicamentos. – 15/07/2024
Prezados (as),
No intuito de otimizar a alocação dos esquemas de tratamento e prevenção da Tuberculose nos serviços que atendem pessoas vivendo com HIV/aids, a Coordenação Geral de Vigilância do HIV/aids (CGHA/Dathi/SVSA/MS) junto à Coordenação Geral de Vigilância da Tuberculose, Micoses Endêmicas e Micobactérias Não Tuberculosas (CGTM/Dathi/SVSA/MS), realizará um levantamento acerca da disponibilidade desses medicamentos nas Unidades Dispensadoras de Medicamento (UDM).
Esse levantamento será realizado através de um alerta incluído no Siclom. Ao acessar o sistema, o profissional deverá responder ao questionamento acerca da disponibilidade dos esquemas na UDM.
O alerta será incluído no Siclom operacional/logístico na quarta-feira, dia 17/07/2024, e ficará disponível até o dia 31/07/2024.
A partir dos resultados, será direcionada a ampliação do acesso das PVHA a intervenções que reduzem a mortalidade pela coinfecção TB/HIV no Brasil.
Qualquer dúvida ou mais informações, use um dos nossos canais:
| Atendimento relacionado aos Protocolos Clínicos e Diretrizes Terapêuticas | Atendimento ao Usuário do SICLOM |
|
E-mail: tratamento@aids.gov.br
|
E-mail: siclom@aids.gov.br
|
Informe n° 22/2024 – Recomendações para prescrição dos antirretrovirais Dolutegravir (50mg) + Darunavir (800mg) / ritonavir (100mg) (com ou sem a Lamivudina 150mg) no PCDT – 12/07/2024
Prezada equipe assistencial,
Em virtude da atualização das recomendações para prescrição dos antirretrovirais Dolutegravir (50mg) + Darunavir (800mg) / ritonavir (100mg) (com ou sem a Lamivudina 150mg) no PCDT para Manejo da Infecção pelo HIV em adultos ( disponível no link: https://www.gov.br/aids/pt-br/central-de-conteudo/pcdts/pcdt_hiv_modulo_1_2024.pdf ), orientamos a dispensação, a partir do dia 17/07/24, conforme as situações específicas a seguir:
- Pessoas em início de tratamento ou introdução de Tarv após perda de seguimento: está autorizado apenas para pacientes potencialmente graves nos casos de contraindicação ao TDF, ABC ou AZT e a sua manutenção está condicionada à aprovação pela Câmara Técnica Estadual em até 180 dias. Após esse período, não será autorizada a dispensação sem aprovação pela Câmara Técnica Estadual. - Pessoas com Carga Viral indetectável evoluindo com disfunção renal ou osteopenia/osteoporose nos casos de contraindicação à terapia dupla com 3TC + DTG ou 3TC + DRV/r por falha prévia: esquema antirretroviral com DTG +DRV/r liberado através do preenchimento dos campos de CV indetectável; campo 12 troca de Tarv> terapia dupla > falha prévia; campo 14 > contraindicação ao TDF (disfunção renal ou osteopenia/osteoporose). - Pessoas com CV Detectável em falha virológica confirmada por dois exames de quantificação da carga viral -HIV com resultado superior a 200 cópias/mL: recomendamos a solicitação de autorização pela Câmara Técnica Estadual.
Agradecemos pela colaboração e ficamos à disposição para quaisquer esclarecimentos e/ou informações adicionais que se fizerem necessários.
Para esclarecimentos adicionais ou mais informações, utilize um dos canais de comunicação disponíveis:
| Atendimento relacionado aos Protocolos Clínicos e Diretrizes Terapêuticas | Atendimento relacionado à área de Controle de Medicamentos e Insumos do DATHI/SVSA/MS | Atendimento ao Usuário do SICLOM |
|
E-mail: tratamento@aids.gov.br
|
E-mail: logistica@aids.gov.br
|
E-mail: siclom@aids.gov.br
|
Informe n° 21/2024 – Nota Técnica nº 167/2024 – CGAHV/DATHI/SVSA/MS – 12/07/2024
Prezados coordenadores e responsáveis pela logística de ARV, boa tarde!
Segue anexa a NOTA TÉCNICA Nº 167/2024-CGAHV/.DATHI/SVSA/MS, de 10/7/2024, a qual dispõe da descontinuidade do fornecimento dos medicamentos Raltegravir (RAL) 400mg comprimido revestido e Raltegravir (RAL) 100mg comprimido mastigável ao elenco de antirretrovirais no SUS, e reforça orientações sobre esquemas antirretrovirais preferenciais para pessoas vivendo com HIV/aids (PVHA) – 12/07/2024
Para esclarecimentos adicionais ou mais informações, utilize um dos canais de comunicação disponíveis:
| Atendimento relacionado aos Protocolos Clínicos e Diretrizes Terapêuticas | Atendimento relacionado à área de Controle de Medicamentos e Insumos do DATHI/SVSA/MS | Atendimento ao Usuário do SICLOM |
|
E-mail: tratamento@aids.gov.br
|
E-mail: logistica@aids.gov.br
|
E-mail: siclom@aids.gov.br
|
Informe n° 20/2024 – Nota Técnica Conjunta Nº 101/2024-CGICI/DPNI/SVSA/MS – 04/07/2024
Segue a NOTA TÉCNICA CONJUNTA Nº 101/2024-CGICI/DPNI/SVSA/MS, que trata sobre orientações para gestores e profissionais de saúde sobre a disponibilização da vacina HPV4 para usuários de Profilaxia Pré-Exposição (PrEP) de 15 a 45 anos.
Solicita-se ampla divulgação.
Para esclarecimentos adicionais ou mais informações, utilize um dos canais de comunicação disponíveis:
| Atendimento relacionado aos Protocolos Clínicos e Diretrizes Terapêuticas | Atendimento relacionado à área de Controle de Medicamentos e Insumos do DATHI/SVSA/MS | Atendimento ao Usuário do SICLOM |
|
E-mail: tratamento@aids.gov.br
|
E-mail: logistica@aids.gov.br
|
E-mail: siclom@aids.gov.br
|
Informe n° 19/2024 – Lote do medicamento EFAVIRENZ 600MG + LAMIVUDINA 300MG + TENOFOVIR 300 MG – COMPRIMIDO, em embalagens e/ou bulas excepcionais – 01/07/2024
Considerando a necessidade de recebimento no menor prazo possível e a disponibilidade imediata pelo fornecedor do medicamento EFAVIRENZ 600MG + LAMIVUDINA 300MG + TENOFOVIR 300 MG - COMP, o Ministério da Saúde (MS) autorizou, em caráter excepcional, a importação e entrega de lotes do referido medicamento contendo embalagem e/ou bula em não conformidade aos padrões preconizados pelo MS.
Essa excepcionalidade é somente para o lote – 3167372 do medicamento EFAVIRENZ 600MG + LAMIVUDINA 300MG + TENOFOVIR 300 MG - COMPRIMIDO, validade para nov/2025, o qual apresenta embalagem em inglês/francês e bula em inglês/francês, e bula em português.
Os demais lotes estão com embalagens e bulas de acordo com as orientações de fornecimento de medicamentos no serviço público.
Agradecemos pela colaboração habitual e ficamos à disposição para quaisquer esclarecimentos e/ou informações adicionais que se fizerem necessários.
Para esclarecimentos adicionais ou mais informações, utilize um dos canais de comunicação disponíveis:
| Atendimento relacionado aos Protocolos Clínicos e Diretrizes Terapêuticas | Atendimento relacionado à área de Controle de Medicamentos e Insumos do DATHI/SVSA/MS | Atendimento ao Usuário do SICLOM |
|
E-mail: tratamento@aids.gov.br
|
E-mail: logistica@aids.gov.br
|
E-mail: siclom@aids.gov.br
|
Informe n° 18/2024 – Ofício Circular Nº 14/2024/CGHA/.DATHI/SVSA/MS – 26/06/2024
Segue o Ofício Circular Nº 14/2024/CGHA/.DATHI/SVSA/MS, que trata sobre orientações para Unidades Dispensadoras de Medicamentos a respeito da dispensação de terapia dupla para pessoas que vivem com HIV/aids (PVHA), nas situações de novas prescrições médicas da dose fixa combinada de 3TC/DTG (300mg/50mg), em situações que não preenchem os critérios estabelecidos na Nota Técnica Nº 87/2024/CGAHV/Dathi/SVSA/MS.
Solicita-se ampla divulgação.
Para esclarecimentos adicionais ou mais informações, utilize um dos canais de comunicação disponíveis:
| Atendimento relacionado aos Protocolos Clínicos e Diretrizes Terapêuticas | Atendimento relacionado à área de Controle de Medicamentos e Insumos do DATHI/SVSA/MS | Atendimento ao Usuário do SICLOM |
|
E-mail: tratamento@aids.gov.br
|
E-mail: logistica@aids.gov.br
|
E-mail: siclom@aids.gov.br
|
Informe n° 17/2024 – Ofício Circular Nº 11/2024/CGAHV/.DATHI/SVSA/MS – 17/06/2024
Prezados/as
Segue o ofício circular nº 11/2024/CGAHV/.DATHI/SVSA/MS, que apresenta sistematização de documentos referenciais que amparam a oferta das profilaxias pré e pós-exposição de risco ao HIV (PrEP e PEP) por enfermeiros e farmacêuticos no âmbito do Sistema Único de Saúde (SUS).
Solicita-se ampla divulgação.
Para esclarecimentos adicionais ou mais informações, utilize um dos canais de comunicação disponíveis:
| Atendimento relacionado aos Protocolos Clínicos e Diretrizes Terapêuticas | Atendimento relacionado à área de Controle de Medicamentos e Insumos do DATHI/SVSA/MS | Atendimento ao Usuário do SICLOM |
|
E-mail: tratamento@aids.gov.br
|
E-mail: logistica@aids.gov.br
|
E-mail: siclom@aids.gov.br
|
Informe n° 16/2024 – Orientação quanto ao uso da apresentação do medicamento Abacavir (ABC) Solução Oral - 23/5/2024
Prezados Coordenadores e responsáveis pela logística de ARV,
Com o objetivo de assegurar o estoque do medicamento Abacavir (ABC) Solução Oral 20mg/mL (frasco com 240mL) para crianças expostas e vivendo com HIV que não possuem outra opção terapêutica, este Departamento encaminha este informe com critérios gerais e preliminares para substituição da apresentação. Estas sugestões serão detalhadas nos próximos dias. No cenário atual, orienta-se considerar a substituição do ABC Solução Oral 20mg/mL, pelas seguintes alternativas:
• crianças, adolescentes ou adultos em uso da apresentação ABC solução oral com peso maior ou igual à 14kg e com idade > 3 meses, considerar a troca para ABC comprimido de 300mg com dose definida conforme o peso; em situações individualizadas, o comprimido poderá ser macerado, misturado com líquidos ou uma pequena porção de comida semissólida, que devem ser consumidos imediatamente;
Importante ressaltar que essa medida tem como objetivo otimizar os estoques disponíveis, tanto no almoxarifado central das coordenações quanto nas redes locais, de forma a contribuir para a continuidade do acesso ao tratamento. Para os casos em que não há outra opção terapêutica, solicitamos que sejam esgotadas as possibilidades de remanejamento entre os serviços de atendimento a pessoas que vivem com HIV, até a normalização das distribuições. A previsão de normalização da distribuição para os almoxarifados centrais das coordenações, deve ocorrer a partir da 1ª semana de jun/2024.
Para esclarecimentos adicionais ou mais informações, utilize um dos canais de comunicação disponíveis:
| Atendimento relacionado aos Protocolos Clínicos e Diretrizes Terapêuticas | Atendimento relacionado à área de Controle de Medicamentos e Insumos do DATHI/SVSA/MS | Atendimento ao Usuário do SICLOM |
|
E-mail: tratamento@aids.gov.br
|
E-mail: logistica@aids.gov.br
|
E-mail: siclom@aids.gov.br
|
Informe n° 15/2024 – Nota Técnica n° 16/2024/DATHI/SVSA/MS – 14/05/2024
DATHI/SVSA/MS publica Nota técinca sobre critérios de priorização para testagem diagnóstica e exames de monitoramento (carga viral e LT-CD4/CD8) de IST, HIV e hepatites virais para facilitar o acesso dos usuários no contexto do Rio Grande do Sul.
Para esclarecimentos adicionais ou mais informações, utilize um dos canais de comunicação disponíveis:
| Atendimento relacionado aos Protocolos Clínicos e Diretrizes Terapêuticas | Atendimento relacionado à área de Controle de Medicamentos e Insumos do DATHI/SVSA/MS | Atendimento ao Usuário do SICLOM |
|
E-mail: tratamento@aids.gov.br
|
E-mail: logistica@aids.gov.br
|
E-mail: siclom@aids.gov.br
|
Informe n° 14/2024 – Nota Técnica n° 15/2024/DATHI/SVSA/MS – 13/05/2024
Nota técinca sobre a remoção de barreiras de acesso aos antivirais durante a vigência da situação de calamidade pública no Rio Grande do Sul.
Para esclarecimentos adicionais ou mais informações, utilize um dos canais de comunicação disponíveis:
| Atendimento relacionado aos Protocolos Clínicos e Diretrizes Terapêuticas | Atendimento relacionado à área de Controle de Medicamentos e Insumos do DATHI/SVSA/MS | Atendimento ao Usuário do SICLOM |
|
E-mail: tratamento@aids.gov.br
|
E-mail: logistica@aids.gov.br
|
E-mail: siclom@aids.gov.br
|
Informe n° 13/2024 – Nota Técnica n° 115/2024/CGAHV/DATHI/SVSA/MS – 26/04/2024
Prezados farmacêutico e dispensador,
Atenção à Nota técinca que dispõe sobre as recomendações para substituição dos medicamentos Lopinavir 100 mg/ritonavir25 mg (“baby dose”) e Ritonavir 100 mg pó para suspensão oral ao elenco terapêutico de antirretrovirais no SUS.
Para esclarecimentos adicionais ou mais informações, utilize um dos canais de comunicação disponíveis:
| Atendimento relacionado aos Protocolos Clínicos e Diretrizes Terapêuticas | Atendimento relacionado à área de Controle de Medicamentos e Insumos do DATHI/SVSA/MS | Atendimento ao Usuário do SICLOM |
|
E-mail: tratamento@aids.gov.br
|
E-mail: logistica@aids.gov.br
|
E-mail: siclom@aids.gov.br
|
Informe n° 12/2024 – Nota Técnica n° 8/2024/CGAHV/.DATHI/SVSA/MS – 11/04/2024
Prezados farmacêutico e dispensador,
Em atenção à Nota Técnica n° 8/2024-CGAHV/.DATHI/SVSA/MS, que dispõe sobre a descontinuidade definitiva dos medicamentos Lopinavir 100mg/ritonavir 25 mg (LPV/r; “baby dose”) e Ritonavir 100 mg pó para suspensão oral, a qual foi compartilhada com as Coordenações de HIV/Aids e Equipes de Logística de Antirretrovirais a partir de janeiro de 2024, e considerando que ainda há crianças vivendo com HIV/Aids (CVHA) em uso destas formulações, informa-se que, para os usuários com saldo no formulário de antirretrovirais, o Siclom operacional converterá a dose prescrita de LPV/r 100mg/25mg para LPV/r solução oral 80mg/20mg, de modo a evitar interrupções nos tratamentos. Sobretudo, orienta-se que o serviço priorize o atendimento médico das CVHA que estão em uso de combinações contendo LPV/r 100mg/25mg, para avaliação de novo esquema terapêutico. A nota encontra-se disponível no website do Departamento de HIV/Aids, Tuberculose, Hepatites Virais e Infecções Sexualmente Transmissíveis (DATHI/SVSA/MS): https://www.gov.br/aids/pt-br/central-de-conteudo/notas-tecnicas/2024/sei_ms-0038363009-nota-tecnica-8_2024_descontinuidade-definitiva_lpvr-100mg_25mg-e-ritonavir-po.pdf.
Adicionalmente, recomenda-se que o farmacêutico preste a assistência necessária, de modo a reiterar ao responsável pela CVHA que se trata do mesmo medicamento; porém, com forma farmacêutica diferente.
Para esclarecimentos adicionais ou mais informações, utilize um dos canais de comunicação disponíveis:
| Atendimento relacionado aos Protocolos Clínicos e Diretrizes Terapêuticas | Atendimento relacionado à área de Controle de Medicamentos e Insumos do DATHI/SVSA/MS | Atendimento ao Usuário do SICLOM |
|
E-mail: tratamento@aids.gov.br
|
E-mail: logistica@aids.gov.br
|
E-mail: siclom@aids.gov.br
|
Informe n° 11/2024 – Dispõe sobre a Nota Técnica n 87/2024 que amplia a faixa etária para 40 anos – 22/03/2024
Esta Nota Técnica tem como objetivo ampliar a disponibilização da DFC composta por lamivudina 300mg/DTG 50mg para pessoas com idade igual ou superior a 40 anos cuja prescrição da terapia dupla com lamivudina e dolutegravir (monofármacos) tenha ocorrido até 1º de março de 2024, a fim de melhorar a qualidade de vida e promover maior adesão à terapia antirretroviral.
Para esclarecimentos adicionais ou mais informações, utilize um dos canais de comunicação disponíveis:
| Atendimento relacionado aos Protocolos Clínicos e Diretrizes Terapêuticas | Atendimento relacionado à área de Controle de Medicamentos e Insumos do DATHI/SVSA/MS | Atendimento ao Usuário do SICLOM |
|
E-mail: tratamento@aids.gov.br
|
E-mail: logistica@aids.gov.br
|
E-mail: siclom@aids.gov.br
|
Informe n° 10/2024 - Sobre a dispensa de 3TC/DTG (coformulação) – 18/03/2024
Para usuários em uso de Lamivudina e Dolutegravir em comprimidos separados, que estão contemplados na nota técnica 35/2024, aparecerá automaticamente na aba da dispensação a opção da dose fixa combinada (Lamivudina + Dolutegravir), sem a necessidade de informar mudança de tratamento, nem inserir novo formulário.
Apenas em situações de estoque crítico de Lamivudina monodroga, para pacientes que não atendem aos critérios da nota técnica 35/2024 e que estejam em uso de Lamivudina + Dolutegravir (separados) ou Lamivudina + Dolutegravir (separados) + outro ARV a unidade deverá realizar a mudança de tratamento por motivo de "falta de medicamento/Estoque crítico" para o uso da DFC.
Para esclarecimentos adicionais ou mais informações, utilize um dos canais de comunicação disponíveis:
| Atendimento relacionado aos Protocolos Clínicos e Diretrizes Terapêuticas | Atendimento relacionado à área de Controle de Medicamentos e Insumos do DATHI/SVSA/MS | Atendimento ao Usuário do SICLOM |
|
E-mail: tratamento@aids.gov.br
|
E-mail: logistica@aids.gov.br
|
E-mail: siclom@aids.gov.br
|
Informe n° 09/2024 - Assunto: Manutenção Programada nos bancos de dados dos sistemas corporativos – 18/03/2024 (alterado em 22/03/2024)
Descrição: Atualização e otimização dos bancos de dados utilizados nos sistemas corporativos.
Datas: 28/03/2024 as 19h00 (quinta-feira) a 31/03/2024 as 18h00 (Domingo).
Tipo de Indisponibilidade: Indisponibilidade total durante o período.
Serviços Afetados: Todos os sistemas do DATHI.
Para esclarecimentos adicionais ou mais informações, utilize um dos canais de comunicação disponíveis:
| Atendimento relacionado aos Protocolos Clínicos e Diretrizes Terapêuticas | Atendimento relacionado à área de Controle de Medicamentos e Insumos do DATHI/SVSA/MS | Atendimento ao Usuário do SICLOM |
|
E-mail: tratamento@aids.gov.br
|
E-mail: logistica@aids.gov.br
|
E-mail: siclom@aids.gov.br
|
Informe n° 08/2024 - Sobre alterações do Saldo residual do formulário e sobre a dispensa de 3TC/DTG (coformulação) – 13/03/2024
1- A partir da data da prescrição digitada na dispensação do SICLOM, o saldo residual de ARV será ajustado da seguinte forma: • Para saldos acima de 80 dias, o saldo será atualizado para 90 dias (3 meses); • Para saldos acima de 50 dias, o saldo será atualizado para 60 dias (2 meses); • Para saldos abaixo de 30 dias, o saldo será atualizado para 30 dias (1 mês); Esta ação visa não fragmentar as dispensações, bem como garantir para o usuário a maior cobertura de TARV possível.
2- Para usuários em uso de Lamivudina e Dolutegravir em comprimidos separados, que estão contemplados na nota técnica 35/2024, aparecerá automaticamente na aba da dispensação a opção da dose fixa combinada (Lamivudina + Dolutegravir), sem a necessidade de informar mudança de tratamento, nem inserir novo formulário.
3- Apenas em situações de estoque crítico de Lamivudina monodroga, para pacientes que não atendem aos critérios da nota técnica 35/2024 e que estejam em uso de Lamivudina + Dolutegravir (separados) ou Lamivudina + Dolutegravir (separados) + outro ARV a unidade deverá realizar a mudança de tratamento por motivo de "falta de medicamento/Estoque crítico" para o uso da DFC.
Para esclarecimentos adicionais ou mais informações, utilize um dos canais de comunicação disponíveis:
| Atendimento relacionado aos Protocolos Clínicos e Diretrizes Terapêuticas | Atendimento relacionado à área de Controle de Medicamentos e Insumos do DATHI/SVSA/MS | Atendimento ao Usuário do SICLOM |
|
E-mail: tratamento@aids.gov.br
|
E-mail: logistica@aids.gov.br
|
E-mail: siclom@aids.gov.br
|
Informe n° 07/2024 - Inventário Nacional de Antirretroviral e Talidomida
Conforme acordado em reunião nacional com as equipes de logística de antirretrovirais (ARV), em Março de 2024 deverá ser realizado o Inventário Nacional de Antirretroviral e Talidomida.
Dessa forma, o Mapa de Inventário de Março/2024 ficará aberto entre 01 de abril e 02 de abril p.f., e deverá ser devidamente preenchido no SICLOM Operacional (UDM) e no Gerencial (Almoxarifados e MAT/URE).
Os procedimentos permanecem inalterados, com destaque para (1) a obrigatoriedade de preenchimento dos lotes e prazos de validade pelos usuários que ainda não utilizam o SICLOM Operacional e (2) o fechamento do Mapa de Inventário exclusivamente pelo SICLOM Operacional quando realizar ajuste de estoque no SICLOM Operacional, pois os ajustes feitos no SICLOM Gerencial não serão refletidos automaticamente no estoque do SICLOM Operaciona.
Informe – Inventário Nacional de ARV e Talidomida – Mar/23
Para esclarecimentos adicionais ou mais informações, utilize um dos canais de comunicação disponíveis:
| Atendimento relacionado aos Protocolos Clínicos e Diretrizes Terapêuticas | Atendimento relacionado à área de Controle de Medicamentos e Insumos do DATHI/SVSA/MS | Atendimento ao Usuário do SICLOM |
|
E-mail: tratamento@aids.gov.br
|
E-mail: logistica@aids.gov.br
|
E-mail: siclom@aids.gov.br
|
Informe Nº 06/2024: Novo Formulário de Solicitação de Medicamentos – Adolescente ( >12 anos), Gestante e Adulto -05/03/2024
Está disponível no http://azt.aids.gov.br , na aba Documentos, o novo Formulário de Solicitação de Medicamentos – Adolescente ( >12 anos), Gestante e Adulto.
As alterações foram baseadas nas atualizações dos Protocolos Clínicos e Diretrizes Terapêuticas (PCDT) vigentes, bem como na melhoria da identidade visual e usabilidade do formulário.
IMPORTANTE: A validade de todos os formulários passa a ser de 180 dias, mas a duração da dispensa continua em 30, 60 e 90 conforme a avaliação do farmacêutico.
Para esclarecimentos adicionais ou maiores informações, utilize um dos canais de comunicação disponíveis:
| Atendimento relacionado aos Protocolos Clínicos e Diretrizes Terapêuticas | Atendimento relacionado à área de Controle de Medicamentos e Insumos do DCCI/SVSA/MS | Atendimento ao Usuário do SICLOM |
|
E-mail: tratamento@aids.gov.br
|
E-mail: logistica@aids.gov.br
|
E-mail: siclom@aids.gov.br
|
Informe Nº 05/2024: NOTA TÉCNICA Nº 35/2024-CGAHV/.DATHI/SVSA/MS – 29/02/2024
Prezados/as,
Segue a Nota Técnica Nº 35/2024-CGAHV/.DATHI/SVSA/MS que dispõe sobre as orientações para migração da terapia dupla em monofármacos de lamivudina 150mg (2 comprimidos) associado a dolutegravir 50 mg (1comprimido) para apresentação em dose fixa combinada (DFC: lamivudina 300mg/dolutegravir 50 mg) para pessoas com idade igual ou superior a 50 anos em terapia dupla até a data 30/11/2023.
Solicitamos ampla divulgação.
Para esclarecimentos adicionais ou maiores informações, utilize um dos canais de comunicação disponíveis:
| Atendimento relacionado aos Protocolos Clínicos e Diretrizes Terapêuticas | Atendimento relacionado à área de Controle de Medicamentos e Insumos | Atendimento ao Usuário(a) do SICLOM |
|
E-mail: tratamento@aids.gov.br
|
E-mail: prevencao@aids.gov.br
|
E-mail: siclom@aids.gov.br
|
Informe Nº 04/2024: atualização da ficha de atendimento para PrEP – monitoramento da Mpox – 23/02/2024
Considerando a necessidade de monitoramento de suspeita ou diagnóstico de Mpox entre os usuários de PrEP, foram inseridas na ficha de atendimento, campo 12 (sintomas/diagnóstico de Infecções Sexualmente Transmissíveis), as opções “suspeita de Mpox” e “fui diagnosticado com Mpox”. A ficha atualizada se encontra disponível no Siclom gerencial, submenu documentos>>formulários>>ficha de atendimento PrEP ou clique aqui para baixar.
Solicitamos ampla divulgação.
Para esclarecimentos adicionais ou maiores informações, utilize um dos canais de comunicação disponíveis:
| Atendimento relacionado aos Protocolos Clínicos e Diretrizes Terapêuticas | Atendimento relacionado à área de Controle de Medicamentos e Insumos | Atendimento ao Usuário(a) do SICLOM |
|
E-mail: tratamento@aids.gov.br
|
E-mail: prevencao@aids.gov.br
|
E-mail: siclom@aids.gov.br
|
Informe Nº 03/2024: Nota Técnica Nº 26/2024-CGAHV/.DATHI/SVSA/MS - uso do autoteste de HIV para início e seguimento da Profilaxia Pré-Exposição (PrEP).
Prezados/as,
Segue a Nota Técnica Nº 26/2024-CGAHV/.DATHI/SVSA/MS que dispõe sobre recomendações acerca do uso do autoteste de HIV para início e seguimento da Profilaxia Pré-Exposição (PrEP) oral de risco ao HIV no contexto do teleatendimento.
Solicitamos ampla divulgação.
Para esclarecimentos adicionais ou maiores informações, utilize um dos canais de comunicação disponíveis:
| Atendimento relacionado aos Protocolos Clínicos e Diretrizes Terapêuticas | Atendimento relacionado à área de Controle de Medicamentos e Insumos | Atendimento ao Usuário(a) do SICLOM |
|
E-mail: tratamento@aids.gov.br
|
E-mail: prevencao@aids.gov.br
|
E-mail: siclom@aids.gov.br
|
Informe Nº 02/2024: Dispensação de medicamentos a usuários de terapia antirretroviral ou profilaxia pré-exposição ao HIV na ausência de formulário de solicitação.
Prezado farmacêutico e dispensador,
Tendo em vista que o Sistema de Controle Logístico de Medicamentos (Siclom) controla a dispensação de medicamentos para terapia antirretroviral (TARV) e profilaxia pré-exposição ao HIV (PrEP), e levando em consideração as recomendações da Nota Informativa n° 75/2016 - DDAHV-SVS-MS, que aborda orientações gerais sobre a dispensação, transporte e armazenamento dos medicamentos antirretrovirais na rede pública de saúde, sugere que os formulários de antirretrovirais fiquem em posse da Unidade Dispensadora de Medicamentos (UDM) até a expiração da sua validade e, após esse período, não há obrigatoriedade de guarda pelos serviços. Além disso, considerando as metas 95-95-95, firmadas entre a Organização das Nações Unidas (ONU) e seus países-membros, é destacado que a meta mais desafiadora para o Brasil é consiste no acesso ininterrupto à TARV para pessoas vivendo com HIV/Aids, com uma taxa de aproximadamente 81%.
Diante desse contexto, este comunicado recomenda que as UDM viabilizem, sempre que possível, a dispensação de antirretrovirais para usuários de TARV ou PrEP que não estão fisicamente com formulário de solicitação de medicamentos, mas que possuem saldo a receber no Siclom, independentemente do município de origem da sua UDM, de forma a não prejudicar a continuidade da profilaxia ou do tratamento do usuário. Para usuários em TARV clinicamente estáveis, a dispensação poderá ser realizada para até 90 dias de tratamento, conforme especificado na Nota Técnica n° 6/2022/CGAHV/DCCCI/SVS/MS. Como medida de comprovação, sugere-se que a UDM imprima o recibo de dispensação do Siclom e obtenha a assinatura do usuário.
Nos casos em que não haja saldo a receber no Siclom, recomenda-se que a equipe de saúde viabilize consulta ao usuário.
Com exceção de moradores de rua, na qual a dispensação poderá ser realizada mediante apresentação do Cartão Nacional do SUS, o solicitante deverá apresentar à UDM documento oficial com foto.
Solicitamos ampla divulgação.
Para esclarecimentos adicionais ou maiores informações, utilize um dos canais de comunicação disponíveis:
| Atendimento relacionado aos Protocolos Clínicos e Diretrizes Terapêuticas | Atendimento relacionado ao Núcleo de Prevenção do HIV | Atendimento ao Usuário(a) do SICLOM |
|
E-mail: tratamento@aids.gov.br
|
E-mail: prevencao@aids.gov.br
|
E-mail: siclom@aids.gov.br
|
Informe Nº 01/2024: Formulário com apresentação em dose fixa combinada - DFC: lamivudina 300mg/dolutegravir 50mg (em caráter provisório).
Tendo em vista a necessidade de adequação do Formulário de Solicitação de Medicamentos – Adolescente (>12 anos), Gestante e Adulto à dispensação da DFC de 3TC/DTG, está disponível no https://azt.aids.gov.br na aba documentos o arquivo (em caráter provisório) que contém a nova apresentação.
Um novo formulário contemplando as atualizações do novo PDCT será liberado em 09/02/2024.
Solicitamos ampla divulgação.
Para esclarecimentos adicionais ou maiores informações, utilize um dos canais de comunicação disponíveis:
| Atendimento relacionado aos Protocolos Clínicos e Diretrizes Terapêuticas | Atendimento relacionado à área de Controle de Medicamentos e Insumos | Atendimento ao Usuário(a) do SICLOM |
|
E-mail: tratamento@aids.gov.br
|
E-mail: logistica@aids.gov.br
|
E-mail: siclom@aids.gov.br
|
Informe Nº 38/2023: OFÍCIO CIRCULAR Nº 1/2024 E NOTA TÉCNICA Nº 1/2024: Orientações acerca do Cadastramento de Unidades Dispensadoras de Medicamentos (UDM) para dispensação das profilaxias pré e pós-exposição ao Vírus da Imunodeficiência Humana (HIV) no Sistema de Controle Logístico de Medicamentos (Siclom).
Prezadas equipes da coordenação HIV e logística de medicamentos antirretrovirais (ARV), boa tarde!
Seguem, em anexo, o OFÍCIO CIRCULAR Nº 1/2024/CGAHV/.DATHI/SVSA/MS e a NOTA TÉCNICA Nº 1/2024-CGAHV/.DATHI/SVSA/MS * , ambos os documentos assinados em 3/1/2024, por meio dos quais o Departamento de HIV/Aids, Tuberculose, Hepatites Virais e Infecções Sexualmente Transmissíveis (DATHI) orienta o cadastramento de Unidades Dispensadoras de Medicamentos (UDM) para dispensação das profilaxias pré e pós-exposição ao Vírus da Imunodeficiência Humana (HIV) no Sistema de Controle Logístico de Medicamentos (Siclom).
Convém solicitar ampla divulgação deste informe e dos documentos anexos!
Para esclarecimentos adicionais ou maiores informações, utilize um dos canais de comunicação disponíveis:
| Atendimento relacionado aos Protocolos Clínicos e Diretrizes Terapêuticas | Atendimento relacionado à área de Controle de Medicamentos e Insumos | Atendimento ao Usuário(a) do SICLOM |
|
E-mail: tratamento@aids.gov.br
|
E-mail: logistica@aids.gov.br
|
E-mail: siclom@aids.gov.br
|
* Também disponível na página do DATHI/SVSA/MS na internet: https://www.gov.br/aids/pt-br/central-de-conteudo/notas-tecnicas/2024.
Informe Nº 37/2023: Nota Informativa nº 12/2023-CGAHV/.DATHI/SVSA/MS - 27/12/2023
Segue a Nota Informativa nº 12/2023-CGAHV/.DATHI/SVSA/MS que reforça, em caráter excepcional e transitório, as indicações de escolha e alternativas para estruturar esquemas antirretrovirais para profilaxia da infecção pelo HIV em crianças expostas e revoga a Nota Informativa nº 11/2023/CGAHV/DATHI/SVSA/MS, de 07/12/2023.
Solicitamos ampla divulgação.
Para esclarecimentos adicionais ou maiores informações, utilize um dos canais de comunicação disponíveis:
| Atendimento relacionado aos Protocolos Clínicos e Diretrizes Terapêuticas | Atendimento relacionado à área de Controle de Medicamentos ARV | Atendimento ao Usuário(a) do SICLOM |
|
E-mail: tratamento@aids.gov.br
|
E-mail: logistica@aids.gov.br
|
E-mail: siclom@aids.gov.br
|
Informe Nº 36/2023: Divulgação de materiais produzidos pelo Conselho Federal de Farmácia (CFF) sobre a atuação do farmacêutico nas Profilaxias Pré e Pós exposição ao HIV (PrEP e PEP, respectivamente).
Prezados/as Coordenadores/as e Responsáveis pela Logística de Antirretrovirais,
Seguem os links de dois guias elaborados pelo Conselho Federal de Farmácia (CFF), que tratam sobre a atuação do farmacêutico nas Profilaxias Pré e Pós exposição de risco ao HIV (PrEP e PEP, respectivamente):
• Guia de Atuação do Farmacêutico na Profilaxia Pré-Exposição ao Risco de Infecção pelo HIV (PREP) https://admin.cff.org.br/src/uploads/publicacao/arquivo/04cee8a2dbfa9af3cc677b2e598a51f3b045b1e9.pdf
• Guia de Atuação do Farmacêutico na Profilaxia Pós-Exposição ao Risco de infecção pelo HIV (PEP) https://admin.cff.org.br/src/uploads/publicacao/arquivo/a682fbf7b821f4bdb70b7eef64fb8648b774613e.pdf
Espera-se que esses materiais possam colaborar na ampliação da oferta da PrEP e PEP nos territórios, de modo a reduzir as iniquidades no acesso as profilaxias.
Para esclarecimentos adicionais ou maiores informações, utilize um dos canais de comunicação disponíveis:
| Atendimento relacionado aos Protocolos Clínicos e Diretrizes Terapêuticas | Atendimento relacionado à área de Controle de Medicamentos ARV | Atendimento ao Usuário(a) do SICLOM |
|
E-mail: tratamento@aids.gov.br
|
E-mail: logistica@aids.gov.br
|
E-mail: siclom@aids.gov.br
|
Informe Nº 35/2023: Nota Técnica nº 11/2023-CGAHV/.DATHI/SVSA/MS - 11/12/2023
Segue a Nota Informativa nº 11/2023-CGAHV/.DATHI/SVSA/MS que reforça, em caráter temporário e transitório, as indicações de escolha e alternativas para estruturar esquemas antirretrovirais para profilaxia da infecção pelo HIV em crianças expostas.
Solicitamos ampla divulgação.
Para esclarecimentos adicionais ou maiores informações, utilize um dos canais de comunicação disponíveis:
| Atendimento relacionado aos Protocolos Clínicos e Diretrizes Terapêuticas | Atendimento relacionado à área de Controle de Medicamentos ARV | Atendimento ao Usuário(a) do SICLOM |
|
E-mail: tratamento@aids.gov.br
|
E-mail: logistica@aids.gov.br
|
E-mail: siclom@aids.gov.br
|
INFORME Nº 34/2023 - Nota Técnica Nº 365/2023-CGAHV/.DATHI/SVSA/MS: dispõe sobre as orientações para troca da terapia dupla (lamivudina 150mg – 2 comprimidos - e dolutegravir 50mg) com a utilização de monodrogas para apresentação em dose fixa combinada (DFC: lamivudina 300mg/dolutegravir 50mg) - 06/12/2023
Prezadas equipes da coordenação HIV e logística de medicamentos antirretrovirais (ARV), boa tarde!
Segue, em anexo, a Nota Técnica (NT) Nº 365/2023-CGAHV/.DATHI/SVSA/MS, de 6/12/2023*, a qual dispõe sobre as orientações para troca da terapia dupla (lamivudina 150mg – 2 comprimidos - e dolutegravir 50mg) com a utilização de monodrogas para apresentação em dose fixa combinada (DFC: lamivudina 300mg/dolutegravir 50mg).
A DFC de 3TC/DTG está disponível no Sistema de Controle Logístico de Medicamentos (SICLOM) e poderá ser solicitada a partir da Programação Ascendente (PA) atual, de dez/2023.
Convém orientar as Coordenações de HIV/Aids e equipes de logística de ARV que as solicitações de ressuprimento pela PA tenham como base o padrão de uso da terapia dupla atual, disponível com a associação das monodrogas 3TC 150mg (2 comprimidos/dia) e DTG 50mg (1 comprimido/dia).
Espera-se que a solicitação de DFC de 3TC/DTG para a terapia dupla, em atendimento à cobertura estimada da PA do SICLOM, proporcione diminuição gradativa dos quantitativos de 3TC 150mg e DTG 50mg.
Solicitamos ampla divulgação da NT e deste Informe.
Para esclarecimentos adicionais ou maiores informações, utilize um dos canais de comunicação disponíveis:
| Atendimento relacionado aos Protocolos Clínicos e Diretrizes Terapêuticas | Atendimento relacionado à área de Controle de Medicamentos e Insumos | Atendimento ao Usuário(a) do SICLOM |
|
E-mail: tratamento@aids.gov.br
|
E-mail: logistica@aids.gov.br
|
E-mail: siclom@aids.gov.br
|
* Também disponível na página do DATHI/SVSA/MS na internet: https://www.gov.br/aids/pt-br/central-de-conteudo/notas-tecnicas/2023.
INFORME Nº 33/2023 – Mudanças no SICLOM prevenção
Prezados(as) Coordenadores(as) e responsáveis pela logística dos Insumos de Prevenção. Informamos que desde o dia 1º do mês de novembro/2023 foram implementadas modificações no SICLOM Prevenção. Solicitamos que sejam observadas as seguintes orientações:
1. Mapa almoxarifado: 1.1. Todos os mapas dos almoxarifados precisarão ser fechados, incluindo os municipais, regionais e os estaduais.
2. Mapas consolidados: 2.1. Os perfis municipais, regionais e estaduais, obrigatoriamente precisam fechar os seus mapas consolidados. Isso porque só é possível fechar os mapas consolidados após o fechamento do mapa dos respectivos almoxarifados. 2.2. O fechamento do mapa das UDMs vinculadas não será obrigatório.
3. Pedidos de ressuprimento: 3.1. Perfil Municipal: para solicitação do pedido de ressuprimento o mapa consolidado municipal deverá estar fechado; 3.2. Perfil Regional: para solicitação do pedido de ressuprimento o mapa consolidado regional deverá estar fechado; 3.3. Perfil Estadual: para solicitação do pedido, o mapa consolidado estadual tem que estar fechado, e os pedidos de ressuprimento dos municípios e regionais descentralizados precisam estar fechados. Destaca-se que na janela de elaboração do pedido do estado além de fazer seu pedido, contemplando a necessidade dos municípios e regionais centralizados, o estado precisará aprovar os quantitativos solicitados pelos municípios e regionais descentralizados.
4. Rede de distribuição: 4.1. Possibilidade de incluir os municípios e regionais descentralizados na rede de prevenção estadual – preencher o campo recebe MS com SIM; 1.2. Possibilidade de incluir os dados cadastrais da equipe de logística estadual, regional e municipal.
5. Outras observações: 5.1. O menu plano de necessidades foi retirado; 5.2. O pedido de ressuprimento deverá ser feito pelos estados (SES), SMS municipais; 5.3. O menu rede de distribuição está liberado para os estados e municípios descentralizados.
Convém solicitar ampla divulgação.
Para esclarecimentos adicionais ou maiores informações, utilize um dos canais de comunicação disponíveis:
| Atendimento relacionado ao Núcleo de Prevenção do HIV | Atendimento relacionado à Área de Controle de Medicamentos e Insumos | Atendimento ao(a) Usuário(a) do SICLOM |
|
E-mail: prevencao@aids.gov.br
|
E-mail: logistica.prevencao@aids.gov.br
|
E-mail: siclom@aids.gov.br
|
INFORME Nº 32/2023 – Mudança no acesso ao SICLOM a partir do dia 23/10/2023
Informamos que a partir do dia 23/10/2023 o acesso ao SICLOM se dará pelo CPF da pessoa autorizada a utilizar o sistema, ou seja, ao invés de informar o login anteriormente cadastrado, deverá ser informado no campo LOGIN o número do CPF e a senha atual.
| Atendimento ao Usuário do SICLOM |
|
E-mail: siclom@aids.gov.br |
INFORME Nº 31/2023 – Logística Reversa, Ofício nº 135/2023/VTCLOG - 04/10/2023
Para conhecimento, ampla divulgação e conforme orientação, encaminha-se o Ofício nº 135/2023 , da VTCLOG — Operadora Logística contratada pelo Ministério da Saúde, o qual trata da logística reversa de recolhimento dos insumos de transportes (embalagens térmicas e elementos refrigerados) e da obrigatoriedade de sua devolução no prazo de 2 (dois) dias úteis contados da data da entrega do pedido nas secretárias de saúde, “sob pena de responsabilização, inclusive referente aos prejuízos gerados à VTCLOG”.
Para obter maiores informações, poderá tratar com a Katiane Torres — Coordenação-Geral de Logística de Insumos Estratégicos para a Saúde (CGLOG/DLOG/SE/MS) — pelo e-mail katiane.torres@aids.gov.br
Atenciosamente,

ite
Informe Nº 29/2023: Restabelecimento da distribuição de Gel Lubrificante no SICLOM Prevenção pelo Ministério da Saúde - 18/09/2023
Prezados(as) Coordenadores(as) e responsáveis pela logística dos Insumos de Prevenção.
Informamos que, a partir do próximo período de ressuprimento de insumos de prevenção no SICLOM Prevenção, referente ao mês de outubro/2023, o Ministério da Saúde (MS) voltará a disponibilizar o Gel Lubrificante, e que os pedidos a serem solicitados pelas coordenações estaduais e municipais serão previamente analisados e aprovados considerando a demanda e disponibilidade em estoque no MS.
Convém solicitar ampla divulgação.
Para esclarecimentos adicionais ou maiores informações, utilize um dos canais de comunicação disponíveis:
| Atendimento relacionado ao Núcleo de Prevenção do HIV | Atendimento relacionado à Área de Controle de Medicamentos e Insumos | Atendimento ao Usuário(a) do SICLOM |
|
E-mail: prevencao@aids.gov.br
|
E-mail: logistica.prevencao@aids.gov.br
|
E-mail: siclom@aids.gov.br
|
Informe Nº 28/2023: “REFORÇA AS INDICAÇÕES DE DARUNAVIR DE 600 MG E 800 MG” - 08/09/2023
Prezados Coordenadores e Responsáveis pela Logística de Antirretrovirais,
A disponibilização de formulações e apresentações que simplifiquem os esquemas antirretrovirais, contribuem para o alcance das metas 95/95/95 e para a eliminação da epidemia de Aids como problema de saúde pública no Brasil.
O darunavir 800 mg (DRV 800mg) foi incorporado ao elenco de antirretrovirais, promovendo maior comodidade posológica, melhor adesão ao tratamento, otimizando a retenção no cuidado e a qualidade de vida.
A Coordenação Geral de Vigilância do HIV/Aids (CGHIV/DATHI/SVSA/MS) tem recebido demandas a respeito da dispensação do DRV 600mg.
Destaca-se que desde 2021 - por meio dos informes do Siclom nº 07, 08, 16/2021, 21, 26/2022 e 01, 04/2023 - este Departamento tem orientado a substituição do DRV 600mg para DRV 800mg.
Os critérios de indicação do DRV 800mg e de manutenção do uso de DRV 600 mg foram divulgados na
Nota Informativa (NI) nº 01/2023 CGAHV/DIAHV/SVSA, de 23/02/23.
O prazo para essa migração foi encerrado em março de 2023, conforme a NI 01/2023, a qual foi amplamente divulgada.
Sendo assim, orienta-se que seja divulgada e reforçada a
NI nº 01/2023 CGAHV/DIAHV/SVSA, de 23/02/23.
(a qual anexamos a esta mensagem), junto aos prescritores.
Ressalta-se que sejam desenvolvidas estratégias que permitam a adequação do uso de darunavir, substituindo o DRV 600mg pelo DRV 800mg.
Está disponível no SICLOM operacional, o relatório de pessoas que vivem com HIV ou Aids (PVHA) em uso do DRV 600mg, o qual apoia os serviços para a implementar a substituição pelo DRV 800 mg.
Enfatizamos a importância que as coordenações municipais e estaduais de HIV e IST sejam a referência para implementação estratégia de substituição do DRV, fortalecendo a rede de cuidado local.
Casos que não estejam incluídos nos critérios apresentados na NI nº 01/2023 CGAHV/DIAHV/SVSA, de 23/02/23, os canais de comunicação do DATHI podem ser contatados conforme abaixo:
| Atendimento relacionado aos Protocolos Clínicos e Diretrizes Terapêuticas | Atendimento relacionado à área de Controle de Medicamentos ARV | Atendimento ao Usuário do SICLOM |
|
E-mail: tratamento@aids.gov.br
|
E-mail: logistica@aids.gov.br
|
E-mail: siclom@aids.gov.br
|
Informe Nº 27/2023: Ofício Circular Nº 51/2023/CGAHV/.DATHI/SVSA/MS e Nota Técnica Nº 171/2023-CGAHV/.DATHI/SVSA/MS.
Segue o Ofício Circular Nº 51/2023/CGAHV/.DATHI/SVSA/MS , referente a atualização do fluxo de realização dos exames de Tipificação do Alelo HLA-B*5701, e a Nota Técnica Nº 171/2023-CGAHV/.DATHI/SVSA/MS , que trata sobre o procedimento para realização do exame supracitado. Desde 01/08/2023, os exames de Tipificação do Alelo HLA-B*5701 são realizados pelo Laboratório de AIDS & Imunologia Molecular (LabAIDS) localizado no Instituto Oswaldo Cruz – IOC / Fundação Oswaldo Cruz – FIOCRUZ/RJ.
Solicitamos ampla divulgação.
Para esclarecimentos adicionais ou maiores informações, utilize um dos canais de comunicação disponíveis:
| Atendimento relacionado aos Protocolos Clínicos e Diretrizes Terapêuticas | Atendimento relacionado à área de Controle de Medicamentos ARV | Atendimento relacionado ao fluxo de realização do exame de Tipificação do Alelo HLA-B*5701 |
|
E-mail: tratamento@aids.gov.br
|
E-mail: logistica@aids.gov.br
|
E-mail: diagnostico@aids.gov.br
|
Informe Nº 26/2023: Orienta sobre a inativação de Maternidades/Unidades de Referência em Exposição (MAT/URE) e Unidades Dispensadoras de Medicamentos (UDM) no período de fechamento do Mapa, Boletim e Programação Ascendente (PA) do Siclom.
A equipe do Departamento de HIV/Aids, Tuberculose, Hepatites Virais e Infecções Sexualmente Transmissíveis (DATHI/SVSA/MS) tem recebido ocorrências acerca da inativação de Maternidades/Unidades de Referência em Exposição (MAT/URE) e Unidades Dispensadoras de Medicamentos (UDM) como medida para assegurar o fechamento do Mapa, Boletim e Programação Ascendente (PA) do Sistema de Controle Logístico de Medicamentos (Siclom) pelas Secretarias Estaduais de Saúde (SES) dentro do prazo acordado, sendo esses serviços reativados após o fechamento da PA.
Importante ressaltar que essa medida impacta negativamente as atividades da área de Controle de Medicamentos e Insumos e da equipe do SICLOM do Dathi e, sobremaneira, dos estados, uma vez que o saldo em estoque e o consumo não são contabilizados na PA, o que resulta em um pedido incorreto pelas Secretarias Estaduais e, por vezes, na reabertura da PA para ajustes pela equipe de suporte do SICLOM.
Dessa forma, recomenda-se fortemente que os serviços só sejam inativados em ocasiões de fechamento do serviço, com transferência dos estoques disponíveis ao almoxarifado central ou outra unidade da rede cadastrada no Siclom. E quanto aos atrasos reiterados desses serviços, orienta-se que as SES articulem e pactuem com sua rede o prazo mais adequado para fechamento do Mapa, Boletim (UDM e MAT/URE) e PA (UDM) — como sugestão, preferencialmente até o dia 5 de cada mês —, de forma que haja tempo hábil para que o estado solicite a conclusão do preenchimento aos serviços que não cumpriram com o prazo e não haja prejuízos no fechamento da PA pelas SES até o dia 10 de cada mês.
Estaremos à disposição para prestar esclarecimentos adicionais que se fizerem necessários.
Para esclarecimentos adicionais ou maiores informações, utilize um dos canais de comunicação disponíveis:
| Atendimento relacionado aos Protocolos Clínicos e Diretrizes Terapêuticas | Atendimento relacionado à área de Controle de Medicamentos ARV | Atendimento ao Usuário do SICLOM |
|
E-mail: tratamento@aids.gov.br
|
E-mail: logistica@aids.gov.br
|
E-mail: siclom@aids.gov.br
|
Informe 25/2023: Nota Técnica Nº 181/2023-CGAHV/.DATHI/SVSA/MS e Ofício Circular Nº 54/2023/CGAHV/.DATHI/SVSA/MS
Seguem a Nota Técnica Nº 181/2023-CGAHV/.DATHI/SVSA/MS , com recomendação da solicitação dos exames de quantificação da carga viral do HIV e quantificação de linfócitos T CD4+ por farmacêuticos atuantes nos serviços do Sistema Único de Saúde (SUS) para o monitoramento de Pessoas Vivendo com HIV/Aids (PVHA), e o Ofício Circular Nº 54/2023/CGAHV/.DATHI/SVSA/MS , que trata sobre a aprovação da solicitação de acesso dos farmacêuticos que atuam na rede de cuidado às pessoas vivendo com HIV/Aids do Sistema Único de Saúde ao Sistema Laudo, em referência à Nota Técnica Nº 181/2023-CGAHV/.DATHI/SVSA/MS.
Solicitamos ampla divulgação.
Para esclarecimentos adicionais ou maiores informações, utilize um dos canais de comunicação disponíveis:
| Atendimento relacionado aos Protocolos Clínicos e Diretrizes Terapêuticas | Atendimento relacionado à área de Controle de Medicamentos ARV | Atendimento ao Usuário do SICLOM |
|
E-mail: tratamento@aids.gov.br
|
E-mail: logistica@aids.gov.br
|
E-mail: siclom@aids.gov.br
|
Informe Nº 24/2023: Inventário Nacional de Antirretroviral, Insumos de Prevenção e Talidomida - 31/07/2023
Conforme acordado em reunião nacional com as equipes de logística de antirretrovirais (ARV), em agosto de 2023 deverá ser realizado o Inventário Nacional de Antirretroviral e Talidomida.
Dessa forma, o Mapa de Inventário de Agosto/2023 ficará aberto entre 31 de agosto e 1º de setembro p.f., e deverá ser devidamente preenchido no SICLOM Operacional (UDM) e no Gerencial (Almoxarifados e MAT/URE).
Os procedimentos permanecem inalterados, com destaque para (1) a obrigatoriedade de preenchimento dos lotes e prazos de validade pelos usuários que ainda não utilizam o SICLOM Operacional e (2) o fechamento do Mapa de Inventário exclusivamente pelo SICLOM Operacional quando realizar ajuste de estoque no SICLOM Operacional, pois os ajustes feitos no SICLOM Gerencial não serão refletidos automaticamente no estoque do SICLOM Operacional.
Informe – Inventário Nacional de ARV e Talidomida – Ago/23
Para esclarecimentos adicionais ou mais informações, utilize um dos canais de comunicação disponíveis:
| Atendimento relacionado aos Protocolos Clínicos e Diretrizes Terapêuticas | Atendimento relacionado à área de Controle de Medicamentos ARV | Atendimento ao Usuário do SICLOM |
|
E-mail: tratamento@aids.gov.br
|
E-mail: logistica@aids.gov.br
|
E-mail: siclom@aids.gov.br
|
Informe Nº 23/2023: Lotes do medicamento antirretroviral Zidovudina (AZT) Solução oral 10mg/mL – Frasco de 240ml com embalagens e bulas em inglês/francês – 27/07/2023
Em função de dificuldades no processo produtivo por parte do fornecedor e considerando a necessidade de recebimento no menor prazo possível do medicamento AZT solução oral 10mg/mL (frasco com 240mL), o Ministério da Saúde (MS) autorizou, em caráter excepcional, a importação e entrega pela Organização Pan-Americana da Saúde (Opas) de quatro lotes do medicamento com embalagens e bulas em inglês/francês que estavam disponíveis para a pronta entrega.
Essa excepcionalidade é somente para os lotes: BZZ2317A, BZZ2319A, BZZ2320A e BZZ2321A, com validade para set/2024. Os demais lotes contratados e a serem incluídos nas próximas distribuições estarão com embalagens e bulas internas em português.
Informamos que juntamente com a entrega desses lotes serão enviadas as bulas em português impressas para distribuição às Unidades Dispensadoras de Medicamentos (UDM). Além disso, segue a cópia da bula em português para conhecimento e ampla divulgação a todos os atores envolvidos na cadeia de distribuição, especialmente aos profissionais que realizam a dispensação dos medicamentos, de forma que efetuem as devidas orientações às pessoas vivendo com HIV/aids (PVHA) quando da dispensação pelo Sistema de Controle Logístico de Medicamentos (SICLOM) dos lotes mencionados.
Agradecemos a colaboração habitual e seguiremos à disposição para quaisquer esclarecimentos e/ou informações adicionais que se fizerem necessários.
Se necessário, utilize um dos canais de comunicação disponíveis:
| Atendimento relacionado aos Protocolos Clínicos e Diretrizes Terapêuticas | Atendimento relacionado à área de Controle de Medicamentos ARV | Atendimento ao Usuário do SICLOM |
|
E-mail: tratamento@aids.gov.br
|
E-mail: logistica@aids.gov.br
|
E-mail: siclom@aids.gov.br
|
Informe Nº 22/2023: Inventário Anual do Almoxarifado do Ministério da Saúde
Informamos que o Almoxarifado do Ministério da Saúde - CDL/SP estará em inventário anual de 28/8/2023 a 10/9/2023. Nesse período não haverá distribuição de medicamentos para as coordenações, somente até 10/8/2023 e a partir de 10/9/2023 quando as atividades do almoxarifado serão retomadas.
Dessa forma, solicitamos que o pedido de medicamentos de ago/2023 pela Programação Ascendente (PA) do SICLOM seja realizado, excepcionalmente, até o dia 8/8/2023, para que haja tempo hábil deste DATHI solicitar o envio dos pedidos ao almoxarifado do Ministério da Saúde.
De forma a auxiliar esse processo junto ao CDL/SP, solicitamos o fechamento da PA de ago/2023 no menor prazo possível.
Agradecemos pela colaboração habitual e ficamos à disposição para quaisquer esclarecimentos adicionais.
Para esclarecimentos adicionais ou maiores informações, utilize um dos canais de comunicação disponíveis:
| Atendimento relacionado aos Protocolos Clínicos e Diretrizes Terapêuticas | Atendimento relacionado à área de Controle de Medicamentos ARV | Atendimento ao Usuário do SICLOM |
|
E-mail: tratamento@aids.gov.br
|
E-mail: logistica@aids.gov.br
|
E-mail: siclom@aids.gov.br
|
Informe Nº 21/2023: Encaminha-se o Ofício nº 1132/2023, que reforça as recomendações do dolutegravir 5mg para profilaxia e tratamento de crianças vivendo com HIV/Aids
Segue o OFÍCIO Nº 1132/2023/CGAHV/.DATHI/SVSA/MS, que dispõe sobre Reforço das indicações de uso do dolutegravir de 5 mg comprimidos dispersíveis para profilaxia pós-exposição (PEP-HIV) e tratamento em crianças vivendo com HIV/aids (CVHA).
Solicitamos ampla divulgação a toda rede, especialmente às Unidades Dispensadoras de Medicamentos (UDM) e aos médicos envolvidos no cuidado à Criança Vivendo com HIV/Aids.
Para esclarecimentos adicionais ou maiores informações, utilize um dos canais de comunicação disponíveis:
| Atendimento relacionado aos Protocolos Clínicos e Diretrizes Terapêuticas | Atendimento relacionado à área de Controle de Medicamentos ARV | Atendimento ao Usuário do SICLOM |
|
E-mail: tratamento@aids.gov.br
|
E-mail: logistica@aids.gov.br
|
E-mail: siclom@aids.gov.br
|
Informe Nº 20/2023: Orientações às unidades dispensadoras de medicamentos quanto ao atraso na realização de exame de carga viral (CV-HIV).
Prezado farmacêutico e dispensador,
O Protocolo Clínico e Diretrizes Terapêuticas para Manejo da Infecção pelo HIV em Adultos (2018) recomenda a realização do exame de carga viral do HIV (CV-HIV), a cada 6 meses, para Pessoas Vivendo com HIV/Aids (PVHA) em seguimento clínico, após 8 semanas do início da terapia antirretroviral (TARV) ou da sua modificação em razão de falha virológica, e após 4 semanas da primeira CV-HIV detectável para confirmação da falha virológica do HIV. Os exames laboratoriais para monitoramento clínico da PVHA, especificamente a CV-HIV, são importantes para assegurar o sucesso terapêutico. Contudo, recomenda-se que, para as situações em que houver atraso na realização de exames, o farmacêutico e/ou dispensador orientem ao usuário a buscar o serviço ambulatorial ao qual está vinculado, de modo que esse efetue os encaminhamentos necessários para realização dos exames de monitoramento clínico da PVHA. Adicionalmente, orienta-se aos farmacêuticos e dispensadores que o atraso na realização dos exames de monitoramento clínico do HIV não seja um fator impeditivo para dispensação da TARV à PVHA (tanto no contexto do primeiro atraso identificado, como no contexto de perda de seguimento), da mesma que devem ser evitadas orientações que possibilitem essa interpretação pelo usuário.
Para esclarecimentos adicionais ou maiores informações, utilize um dos canais de comunicação disponíveis:
| Atendimento relacionado aos Protocolos Clínicos e Diretrizes Terapêuticas | Atendimento relacionado à área de Controle de Medicamentos ARV | Atendimento ao Usuário do SICLOM |
|
E-mail: tratamento@aids.gov.br
|
E-mail: logistica@aids.gov.br
|
E-mail: siclom@aids.gov.br
|
Informe Nº 19/2023: MUDANÇA DE LAYOUT SICLOM – 07/06/2023
Em continuidade às ações de aprimoramento do Sistema Logístico de Medicamentos – SICLOM, informamos que será implantada o na segunda-feira, dia 12/6, uma nova versão do sistema que contará com novo layout e com a capacidade técnica de ser acessado em qualquer navegador. Para ver as novidades clique aqui.
Domingo, a partir das 18 horas o sistema ficará fora para a atualização, já estando disponível na segunda-feira, dia 12 de junho.
Solicitamos ampla divulgação a toda rede de gestão e serviços cadastrados no Sistema de Controle Logístico de Medicamentos (SICLOM), especialmente as Unidades Dispensadoras de Medicamentos Antirretrovirais (UDM).
Para esclarecimentos adicionais ou maiores informações, utilize um dos canais de comunicação disponíveis:
| Atendimento relacionado aos Protocolos Clínicos e Diretrizes Terapêuticas | Atendimento relacionado à área de Controle de Medicamentos ARV | Atendimento ao Usuário do SICLOM |
|
E-mail: tratamento@aids.gov.br
|
E-mail: logistica@aids.gov.br
|
E-mail: siclom@aids.gov.br
|
Informe Nº 18/2023: Ofício Circular nº 41/2023/CGAHV/.DATHI/SVSA/MS – 19/05/2023 e Nota Técnica nº 107/2023-CGAHV/.DATHI/SVSA/MS – 19/05/2023
Seguem o Ofício Circular nº 41/2023/CGAHV/.DATHI/SVSA/MS e Nota Técnica nº 107/2023-CGAHV/.DATHI/SVSA/MS que orientam sobre a ampliação da oferta e disponibilização de preservativos externos (peniano) e internos (vaginal) nos serviços de saúde do SUS e outros estabelecimentos que incluem os setores de assistência social, educação, cultura, justiça, transportes, setor privado, organizações da sociedade civil, dentre outros.
Solicitamos ampla divulgação.
Para esclarecimentos adicionais ou maiores informações, utilize um dos canais de comunicação disponíveis:
| Atendimento relacionado aos Protocolos Clínicos e Diretrizes Terapêuticas de IST e Prevenção da TV de HIV, sífilis e hepatites virais. | Atendimento relacionado à área de Controle de Medicamentos ARV | Atendimento ao Usuário do SICLOM |
|
E-mail: cgist@aids.gov.br
|
E-mail: logistica@aids.gov.br
|
E-mail: siclom@aids.gov.br
|
Informe n° 17/2023 - Ofício Circular nº 37/2023/CGAHV/.DVIAHV/SVSA/MS – 18/05/2023 e Nota Técnica n° 108/2023-CGAHV/.DVIAHV/SVSA/MS – 19/05/2023
Seguem anexos o Ofício Circular nº 37/2023/CGAHV/.DVIAHV/SVSA/MS e Nota Técnica n° 108/2023/CGAHV/.DVIAHV/SVSA/MS, que reforçam as orientações para o cadastramento de Unidades Dispensadoras de Medicamentos(UDM) para o tratamento do HIV/Aids e Hepatites Virais.
Solicitamos ampla divulgação.
Para esclarecimentos adicionais ou maiores informações, utilize um dos canais de comunicação disponíveis:
| Atendimento relacionado aos Protocolos Clínicos e Diretrizes Terapêuticas de IST e Prevenção da TV de HIV, sífilis e hepatites virais. | Atendimento relacionado à área de Controle de Medicamentos ARV | Atendimento ao Usuário do SICLOM |
|
E-mail: cgist@aids.gov.br
|
E-mail: logistica@aids.gov.br
|
E-mail: siclom@aids.gov.br
|
Comunicado Nº 16: Implementação da dupla terapia (Lamivudina+Dolutegravir) na ferramenta análise diária dos esquemas do SICLOM operacional – 03/05/2023
Em continuidade às ações de aprimoramento das dispensações de antirretrovirais pelas Unidades Dispensadoras de Medicamentos (UDM), informamos que foi implementada na ferramenta análise diária dos esquemas do SICLOM operacional a dupla terapia (atualmente, associação do medicamentos isolados Lamivudina e Dolutegravir). Dessa forma, espera-se que essa ferramenta possa auxiliar os dispensadores na tomada de decisão quanto às dispensações para 30, 60 e 90 dias de tratamento, em consonância com a Nota Informativa Nº 6/2022/CGAHV/DCCCI/SVS/MS - dispõe sobre os critérios para ampliação da dispensação dos antirretrovirais para Pessoas Vivendo com HIV em supressão virológica e estáveis clinicamente, para o novo esquema. Cumpre destacar que, para as UDM que não possuem a ferramenta habilitada, a solicitação para liberação deverá ser realizada junto às coordenações e equipes de logística dos estados, as quais avaliarão os parâmetros necessários para sua disponibilização na seção de gerenciador de relatórios >> dispensação do SICLOM operacional.
Solicitamos ampla divulgação a toda rede de gestão e serviços cadastrada no Sistema de Controle Logístico de Medicamentos (SICLOM), especialmente as Unidades Dispensadoras de Medicamentos Antirretrovirais (UDM).
Para esclarecimentos adicionais ou maiores informações, utilize um dos canais de comunicação disponíveis:
| Atendimento relacionado aos Protocolos Clínicos e Diretrizes Terapêuticas | Atendimento relacionado à área de Controle de Medicamentos ARV | Atendimento ao Usuário do SICLOM |
|
E-mail: tratamento@aids.gov.br
|
E-mail: logistica@aids.gov.br
|
E-mail: siclom@aids.gov.br
|
Informe Nº 15: Ofício Circular nº 33/2023/CGAHV/.DVIAHV/SVSA/MS – 27/03/2023 e Nota Técnica nº 72 /2023-CGAHV/.DVIAHV/SVSA/MS – 29/03/2023
Seguem o Ofício Circular nº 33/2023/CGAHV/.DATHI/SVSA/MS e a Nota Técnica nº 72/2023-CGAHV/.DATHI/SVSA/MS , referentes às indicações do medicamento tenofovir alafenamida (TAF) para o tratamento da hepatite B em paciente moninfectados e coinfectados com HIV. Dentre as informações contempladas, destaca-se a inclusão do TAF no SICLOM HIV, com consequente inserção nos fluxos logísticos do sistema. Solicitamos ampla divulgação a toda rede de distribuição cadastrada no SICLOM, especialmente às Unidades Dispensadoras de Medicamentos (UDM).
Para esclarecimentos adicionais ou maiores informações, utilize um dos canais de comunicação disponíveis:
| Atendimento relacionado aos Protocolos Clínicos e Diretrizes Terapêuticas de IST e Prevenção da TV de HIV, sífilis e hepatites virais. | Atendimento relacionado à área de Controle de Medicamentos ARV | Atendimento ao Usuário do SICLOM |
|
E-mail: cgist@aids.gov.br
|
E-mail: logistica@aids.gov.br |
E-mail: siclom@aids.gov.br |
INFORME Nº 14/2023 – Ampliação do prazo de preenchimento do Mapa Inventário no SICLOM - 04/04/2023
Em referência ao Informe Nº 13 anexo, de 29/3/2023, acerca do Inventário Nacional de Antirretroviral e Talidomida, cumpre informar que foi ampliado o prazo para o preenchimento do Mapa Inventário no SICLOM até o dia 10/4/2023 (segunda-feira), considerando os problemas de acesso e a manutenção que tem sido realizada no sistema.
Todos os esforços têm sido empregados para que o restabelecimento do acesso regular ao SICLOM ocorra no menor prazo possível.
Novo comunicado será encaminhado assim que o acesso ao sistema for normalizado.
Para esclarecimentos adicionais ou mais informações, utilize um dos canais de comunicação disponíveis:
| Atendimento relacionado aos Protocolos Clínicos e Diretrizes Terapêuticas. | Atendimento ao Usuário do SICLOM |
|
E-mail: tratamento@aids.gov.br
|
E-mail: siclom@aids.gov.br |
INFORME Nº 13/2023 – Recomendações para preenchimento no formulário de cadastro de Usuários(as) - 30/03/2023
Segue a NOTA TÉCNICA Nº 67/2023-CGAHV/.DATHI/SVSA/MS que dispõe sobre recomendações para preenchimento no formulário de cadastro de usuários(as) do Sistema Único de Saúde (SUS) do Sistema de Controle Logístico de Medicamentos (SICLOM).
Para esclarecimentos adicionais ou mais informações, utilize um dos canais de comunicação disponíveis:
| Atendimento relacionado aos Protocolos Clínicos e Diretrizes Terapêuticas. | Atendimento ao Usuário do SICLOM |
|
E-mail: tratamento@aids.gov.br
|
E-mail: siclom@aids.gov.br |
INFORME Nº 12/2023 – NOVO "FORMULÁRIO DE SOLICITAÇÃO DE MEDICAMENTOS - PREVENÇÃO DA TRANSMISSÃO VERTICAL– HIV" 28/03/2023
Tendo em vista a necessidade de adequação do formulário às novas recomendações para tratamento da infecção pelo HIV em crianças, com disponibilização de Dolutegravir 5mg em nota técnica n° 02/2023/CGAHV/.DCCI/SVS/MS ; e inserção de possibilidade de uso de AZT injetável (em caráter excepcional) para criança exposta ao HIV no parto, elaborou-se a atualização do formulário de solicitação de medicamentos para prevenção da transmissão vertical de HIV. O novo formulário se encontra na aba documentos com a identificação do site https://azt.aids.gov.br/ .
O novo formulário e sua respectiva dispensação estão disponíveis a partir de hoje, na aba de dispensação com denominação TRANSMISSÃO VERTICAL, dia 28/03/2023.
Solicitamos ampla divulgação.
Para esclarecimentos adicionais ou mais informações, utilize um dos canais de comunicação disponíveis:
| Atendimento relacionado aos Protocolos Clínicos e Diretrizes Terapêuticas de IST e Prevenção da TV de HIV, sífilis e hepatites virais. | Atendimento relacionado à área de Controle de Medicamentos ARV | Atendimento ao Usuário do SICLOM |
|
E-mail: cgist@aids.gov.br
|
E-mail: logistica@aids.gov.br |
E-mail: siclom@aids.gov.br |
Informe n° 11/2023 - Inventário Nacional de Antirretroviral e Talidomida
Conforme acordado em reunião nacional com as equipes de logística de antirretrovirais (ARV), em Março de 2023 deverá ser realizado o Inventário Nacional de Antirretroviral e Talidomida.
Dessa forma, o Mapa de Inventário de Março/2023 ficará aberto entre 31 de março e 3 de abril p.f., e deverá ser devidamente preenchido no SICLOM Operacional (UDM) e no Gerencial (Almoxarifados e MAT/URE).
Os procedimentos permanecem inalterados, com destaque para (1) a obrigatoriedade de preenchimento dos lotes e prazos de validade pelos usuários que ainda não utilizam o SICLOM Operacional e (2) o fechamento do Mapa de Inventário exclusivamente pelo SICLOM Operacional quando realizar ajuste de estoque no SICLOM Operacional, pois os ajustes feitos no SICLOM Gerencial não serão refletidos automaticamente no estoque do SICLOM Operacional.
Informe – Inventário Nacional de ARV e Talidomida – Mar/23
Para esclarecimentos adicionais ou mais informações, utilize um dos canais de comunicação disponíveis:
| Atendimento relacionado à área de Controle de Medicamentos e Insumos do DATHI/SVSA/MS | Atendimento ao Usuário do SICLOM |
|
E-mail: logistica@aids.gov.br |
E-mail: siclom@aids.gov.br |
Informe n° 10/2023 - Ofício Circular nº 28/2023/CGAHV/.DVIAHV/SVSA/MS - 20/03/2023 e Nota Informativa n° 4/2023-CGAHV/.DVIAHV/SVSA/MS – 20/03/2023
Seguem anexos o Ofício Circular nº 28/2023/CGAHV/.DVIAHV/SVSA/MS e Nota Informativa n° 4/2023-CGAHV/.DVIAHV/SVSA/MS , quem tratam sobre as indicações do Raltegravir 100mg granulado para suspensão oral e revoga a Nota Informativa Nº 15/2022 – CGAHV/.DCCI/SVS/MS.
Solicitamos ampla divulgação a toda rede de distribuição cadastrada no SICLOM, especialmente às Unidades Dispensadoras de Medicamentos (UDM), Maternidades (MAT) e Unidades de Referência em Exposição (URE).
Para esclarecimentos adicionais ou maiores informações, utilize um dos canais de comunicação disponíveis:
| Atendimento relacionado aos Protocolos Clínicos e Diretrizes Terapêuticas. | Atendimento relacionado à área de Controle de Medicamentos e Insumos do DATHI/SVSA/MS | Atendimento ao Usuário do SICLOM |
|
E-mail: tratamento@aids.gov.br
|
E-mail: logistica@aids.gov.br |
E-mail: siclom@aids.gov.br |
Informe n° 09/2023 - Prescrição das Profilaxias pré e pós exposição ao HIV (PrEP e PEP, respectivamente) por farmacêuticos
Seguem anexos o Ofício Circular nº 48/2023/SVSA/MS – 16/03/2023 , que torna sem efeito o Ofício Circular nº 28/2022/CGAHV/.DCCI/SVS/MS – 06/07/2022 , em que suspendia a liberação da prescrição das profilaxias pré e pós exposição de risco ao HIV (PrEP e PEP, respectivamente) por farmacêuticos e o Ofício Circular nº 23/2023 – CGP/CFF – 17/03/2023 , que ratifica a validade do ofício 015567-2021/CTEC/CFF – 26/11/2021.
Solicitamos ampla divulgação a toda rede de distribuição cadastrada no SICLOM, especialmente às Unidades Dispensadoras de Medicamentos (UDM).
Para esclarecimentos adicionais ou maiores informações, utilize um dos canais de comunicação disponíveis:
| Atendimento relacionado aos Protocolos Clínicos e Diretrizes Terapêuticas. | Atendimento relacionado à área de Controle de Medicamentos e Insumos do DCCI/SVS/MS | Atendimento ao Usuário do SICLOM |
|
E-mail: tratamento@aids.gov.br
|
E-mail: logistica@aids.gov.br |
E-mail: siclom@aids.gov.br |
Informe n° 08/2023: Ofício Circular nº 6/2023/CGAHV/.DVIAHV/SVSA/MS – 24/02/2023 e Nota Informativa nº 1/2023-CGAHV/.DVIAHV/SVSA/MS
Segue o Ofício Circular nº 6/2023/CGAHV/.DVIAHV/SVSA/MS, o qual divulga a Nota Informativa nº 1/2023-CGAHV/.DVIAHV/SVSA/MS, que dispõe sobre o reforço das recomendações técnicas para migração das apresentações de Darunavir para adultos vivendo com HIV/aids.
Solicitamos ampla divulgação a toda rede de distribuição cadastrada no SICLOM, especialmente às Unidades Dispensadoras de Medicamentos (UDM).
Para esclarecimentos adicionais ou maiores informações, utilize um dos canais de comunicação disponíveis:
| Atendimento relacionado aos Protocolos Clínicos e Diretrizes Terapêuticas. | Atendimento relacionado à área de Controle de Medicamentos e Insumos do DCCI/SVS/MS | Atendimento ao Usuário do SICLOM |
|
E-mail: tratamento@aids.gov.br
|
E-mail: logistica@aids.gov.br |
E-mail: siclom@aids.gov.br |
Informe n° 07/2023: Ofício Circular nº 4/2023/CGAHV/.DCCI/SVS/MS – 10/01/2023 e Nota Técnica nº 16/2023-CGAHV/.DCCI/SVS/MS – 11/01/2023
Segue o Ofício Circular nº 4/2023/CGAHV/.DCCI/SVS/MS, o qual divulga a Nota Técnica nº 16/2023-CGAHV/.DCCI/SVS/MS, que dispõe sobre atualização nos critérios de falha terapêutica e de indicação do exame de genotipagem do HIV em crianças/adolescentes vivendo com HIV/aids até 13 (treze) anos de idade.
Solicitamos ampla divulgação a toda rede de distribuição cadastrada no SICLOM, especialmente às Unidades Dispensadoras de Medicamentos (UDM).
Para esclarecimentos adicionais ou maiores informações, utilize um dos canais de comunicação disponíveis:
| Atendimento relacionado aos Protocolos Clínicos e Diretrizes Terapêuticas. | Atendimento relacionado à área de Controle de Medicamentos e Insumos do DCCI/SVS/MS | Atendimento ao Usuário do SICLOM |
|
E-mail: tratamento@aids.gov.br
|
E-mail: logistica@aids.gov.br |
E-mail: siclom@aids.gov.br |
Informe n° 06/2023: Ficha atualizada de atendimento da PrEP
Em razão da nota técnica nº 8/2023 – CGAHV/.DCCI/SVS/MS, publicada em 16 de janeiro de 2023, a qual dispõe sobre recomendações e atualizações acerca do uso da Profilaxia Pré-Exposição de risco à infecção pelo HIV (PrEP) oral, incluindo a modalidade “sob demanda”, informamos que se encontra disponível na seção “Geral>> Documentos>>Formulários” do SICLOM gerencial (http://azt.aids.gov.br) a ficha atualizada de atendimento da PrEP. Dessa forma, solicitamos ampla divulgação a todos os prescritores de PrEP e Unidades Dispensadoras de Medicamentos (UDM).
Para esclarecimentos adicionais ou maiores informações, utilize um dos canais de comunicação disponíveis:
| Atendimento relacionado aos Protocolos Clínicos e Diretrizes Terapêuticas. | Atendimento relacionado à área de Controle de Medicamentos e Insumos do DCCI/SVS/MS | Atendimento ao Usuário do SICLOM |
|
E-mail: tratamento@aids.gov.br
|
E-mail: logistica@aids.gov.br |
E-mail: siclom@aids.gov.br |
Informe n° 05/2023: Ofício Circular n° 02/2023/CGAHV/.DCCI/SVS/MS – 06/01/2023 (comunica reedição da NT 563/2022) e Nota Técnica n° 08/2023/CGAHV/.DCCI/SVS/MS - 12/01/2023 (NT 563/2022 reeditada)
Seguem o ofício circular n° 02/2023/CGAHV/.DCCI/SVS/MS , que trata da reedição da NT 563/2022 - CGAHV/DCCI/SVS/MS, com recomendações e atualizações acerca do uso da Profilaxia Pré-Exposição de risco à infecção pelo HIV (PrEP) oral, incluindo a modalidade “sob demanda” e a nota técnica n° 08/2023/CGAHV/.DCCI/SVS/MS , que dispõe sobre recomendações e atualizações acerca do uso da Profilaxia Pré-Exposição de risco à infecção pelo HIV (PrEP) oral, incluindo a modalidade “sob demanda”.
Para esclarecimentos adicionais ou maiores informações, utilize um dos canais de comunicação disponíveis:
| Atendimento relacionado aos Protocolos Clínicos e Diretrizes Terapêuticas. | Atendimento relacionado à área de Controle de Medicamentos e Insumos do DCCI/SVS/MS | Atendimento ao Usuário do SICLOM |
|
E-mail: tratamento@aids.gov.br
|
E-mail: logistica@aids.gov.br |
E-mail: siclom@aids.gov.br |
Informe n° 04/2023: Migração Darunavir (DRV) 600 mg – 16/01/2023
Em atenção ao processo de migração de Darunavir (DRV) 600mg para a apresentação 800mg, este departamento apresenta informação complementar ao Informe nº 26/2022 de 12/08/2022: o prazo para as trocas será estendido para mais um mês, com nova data para bloqueio do sistema em 03/02/2023.
Para esclarecimentos adicionais ou maiores informações, utilize um dos canais de comunicação disponíveis:
| Atendimento relacionado aos Protocolos Clínicos e Diretrizes Terapêuticas. | Atendimento relacionado à área de Controle de Medicamentos e Insumos do DCCI/SVS/MS | Atendimento ao Usuário do SICLOM |
|
E-mail: tratamento@aids.gov.br
|
E-mail: logistica@aids.gov.br |
E-mail: siclom@aids.gov.br |
Informe n° 03/2023: Ofício Circular n° 03/2023/CGAHV/.DCCI/SVS/MS - 12/01/2023 e Nota Técnica n° 02/2023/CGAHV/.DCCI/SVS/MS - 12/01/2023
Seguem o ofício circular n° 03/2023/CGAHV/.DCCI/SVS/MS, que trata da disponibilização de nova apresentação de Dolutegravir 5mg, comprimido para suspensão, para tratamento de crianças vivendo com HIV/aids e a nota técnica n° 02/2023/CGAHV/.DCCI/SVS/MS , que dispõe sobre as recomendações para tratamento da infecção pelo HIV em crianças com idade igual ou superior a 4 semanas de vida e peso maior ou igual a 3kg. Dessa forma, solicitamos ampla divulgação a toda rede de distribuição cadastrada no SICLOM, especialmente às Unidades Dispensadoras de Medicamentos (UDM).
Para esclarecimentos adicionais ou maiores informações, utilize um dos canais de comunicação disponíveis:
| Atendimento relacionado aos Protocolos Clínicos e Diretrizes Terapêuticas. | Atendimento relacionado à área de Controle de Medicamentos e Insumos do DCCI/SVS/MS | Atendimento ao Usuário do SICLOM |
|
E-mail: tratamento@aids.gov.br
|
E-mail: logistica@aids.gov.br |
E-mail: siclom@aids.gov.br |
Informe n° 02/2023: Sobre novo layout da dispensa Gestante HIV+ no SICLOM Operacional. – 04/01/2023
Prezado/a Dispensador/a
Informamos que dia 04/01/2023, quarta-feira, estaremos disponibilizando uma nova versão da dispensação Gestante HIV+ no SICLOM Operacional em novo layout. Essa mudança visa melhorar o desempenho e o design do sistema.
Para esclarecimentos adicionais ou maiores informações, utilize um dos canais de comunicação disponíveis:
| Atendimento relacionado aos Protocolos Clínicos e Diretrizes Terapêuticas. | Atendimento relacionado à área de Controle de Medicamentos e Insumos do DCCI/SVS/MS | Atendimento ao Usuário do SICLOM |
|
E-mail: tratamento@aids.gov.br
|
E-mail: logistica@aids.gov.br |
E-mail: siclom@aids.gov.br |
Informe n° 01/2023: Complementação ao Informe nº 26/2022 de 12/08/2022, sobre o processo de migração de DRV 600mg para 800mg – 03/01/2023
Em atenção ao processo de migração de Darunavir (DRV) 600mg para a apresentação 800mg, este departamento apresenta informação complementar ao Informe nº 26/2022 de 12/08/2022: o prazo para as trocas será estendido para mais um mês, com nova data para bloqueio do sistema em 03/02/2023.
Para esclarecimentos adicionais ou maiores informações, utilize um dos canais de comunicação disponíveis:
| Atendimento relacionado aos Protocolos Clínicos e Diretrizes Terapêuticas. | Atendimento relacionado à área de Controle de Medicamentos e Insumos do DCCI/SVS/MS | Atendimento ao Usuário do SICLOM |
|
E-mail: tratamento@aids.gov.br
|
E-mail: logistica@aids.gov.br |
E-mail: siclom@aids.gov.br |
Informe n° 44/2022: Nota Técnica 563 – 12/12/2022
Prezado/a Dispensador/a
Como parte das ações de enfrentamento ao HIV/Aids desenvolvidas por este Departamento, vimos informar os gestores e profissionais de saúde do SUS, que ofertam a Profilaxia Pré-Exposição (PrEP) de Risco à Infecção pelo HIV, sobre a publicação da Nota Técnica 563 , que dispõe sobre recomendações e atualizações acerca do uso da Profilaxia Pré-Exposição de risco à infecção pelo HIV (PrEP) oral, incluindo a modalidade “sob demanda”.
Para esclarecimentos adicionais ou maiores informações, utilize um dos canais de comunicação disponíveis:
| Atendimento relacionado aos Protocolos Clínicos e Diretrizes Terapêuticas. | Atendimento relacionado à área de Controle de Medicamentos e Insumos do DCCI/SVS/MS | Atendimento ao Usuário do SICLOM |
|
E-mail: tratamento@aids.gov.br
|
E-mail: logistica@aids.gov.br |
E-mail: siclom@aids.gov.br |
Informe n° 43/2022: Sobre novo layout da dispensa HIV+ no SICLOM Operacional. – 05/12/2022
Prezado/a Dispensador/a
Informamos que dia 06/12/2022, terça-feira, estaremos disponibilizando uma nova versão da dispensação de HIV+ no SICLOM Operacional em novo layout. Essa mudança visa melhorar o desempenho e o design do sistema.
Para esclarecimentos adicionais ou maiores informações, utilize um dos canais de comunicação disponíveis:
| Atendimento relacionado aos Protocolos Clínicos e Diretrizes Terapêuticas. | Atendimento relacionado à área de Controle de Medicamentos e Insumos do DCCI/SVS/MS | Atendimento ao Usuário do SICLOM |
|
E-mail: tratamento@aids.gov.br
|
E-mail: logistica@aids.gov.br |
E-mail: siclom@aids.gov.br |
IINFORME Nº 31/2021 – Dispensa de Antirretrovirais para terceiros - 29/09/2021
A dispensação de antirretrovirais da PrEP e TARV para terceiros corresponde a retirada do medicamento por outra pessoa que não o paciente.
Para essas situações, a comprovação de representação para pacientes impedidos de ir pessoalmente às farmácias credenciadas para retirada de medicamentos e correlatos, não precisa ser impressa e poderá ser realizada por qualquer modelo de procuração, inclusive de próprio punho, desde que nela contenha todas as informações previstas no modelo disponibilizado pelo MS.
O representante do paciente, que assumirá, juntamente com o estabelecimento, a responsabilidade pela efetivação da transação, também deverá apresentar um documento oficial com foto e CPF ou documento de identidade que conste o número do CPF.
No caso de TARV, o próprio paciente pode autorizar pessoalmente a inclusão de pessoas no cadastro do SICLOM, que poderão solicitar as dispensas subsequentes
Solicitamos ampla divulgação a toda rede de distribuição cadastrada no Sistema de Controle Logístico de Medicamentos (SICLOM), especialmente às Unidades Dispensadoras de Medicamentos (UDM).
Para esclarecimentos adicionais ou maiores informações, utilize um dos canais de comunicação disponíveis:
| Atendimento relacionado aos Protocolos Clínicos e Diretrizes Terapêuticas | Atendimento relacionado à área de Controle de Medicamentos ARV | Atendimento ao Usuário do SICLOM |
|
E-mail: tratamento@aids.gov.br |
E-mail: logistica@aids.gov.br |
E-mail: siclom@aids.gov.br |
INFORME nº 08/2020 - Encaminha Ofício Circular nº 07/20 que revoga a Nota Informativa nº 55/2018 e dispõe sobre os requisitos mínimos para atendimento de solicitações excepcionais de dispensação de ARV para mais de 90 dias nos casos de ausência do país - 18/03/2020
Segue anexo Ofício Circular nº 7/20, que revoga a Nota Informativa nº 55/2018, CGAE/DIAHV/SVS/MS e dá novas providências e recomendações sobre requisitos mínimos necessários para atendimento de solicitações excepcionais de dispensação de antirretrovirais (ARV) por períodos superiores a 90 dias de tratamento nos casos de ausências do país das pessoas vivendo com HIV/Aids (PVHIV) em terapia antirretroviral.
Solicitamos ampla divulgação desta nota a toda rede de distribuição cadastrada no Sistema de Controle Logístico de Medicamentos (SICLOM), especialmente às Unidades Dispensadoras de Medicamentos (UDM).
Para esclarecimentos adicionais ou maiores informações, utilize um dos canais de comunicação disponíveis:
| Atendimento relacionado aos Protocolos Clínicos e Diretrizes Terapêuticas. | Atendimento relacionado à área de Controle de Medicamentos e Insumos do DCCI/SVS/MS | Atendimento ao Usuário do SICLOM |
|
E-mail: tratamento@aids.gov.br
|
E-mail: logistica@aids.gov.br |
E-mail: siclom@aids.gov.br |